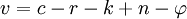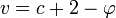- Règle des phases de gibbs
-
Règle des phases
La règle des phases ou règles des phases de Gibbs ou relation de Gibbs donne la variance d'un système thermodynamique à l'équilibre. On doit la règle des phases au physicien américain Josiah Gibbs.
Expression
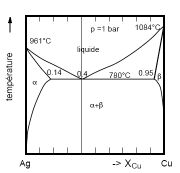
Dans le domaine de stabilité d’une phase, on peut faire varier la température et la pression, et la phase va continuer d’être stable. Au moment où deux phases sont en équilibre, on peut choisir ou la température ou la pression et l’autre paramètre est fixé en même temps. Enfin, le point triple ne laisse aucun degré de liberté car il se trouve à une seule température et une seule pression.
En généralisant cette observation on arrive à la règle des phases de Gibbs qui peut s’écrire :
- c est égal au nombre de corps purs en présence.
- r est le nombre d'équations chimiques indépendantes.
- k est le nombre de relations imposées par l'expérimentateur.
- n est le nombre de facteurs (variables intensives) dont dépend le système ; dans la très grande majorité des cas, ce sont la température et la pression, et n = 2, mais il arrive que la pression ne soit pas un facteur d'équilibre (auquel cas n = 1).
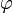 est le nombre de phases présentes dans le système.
est le nombre de phases présentes dans le système.
Dans le cas très courant d'un mélange sans contrainte extérieure (k=0), dans lequel aucune réaction chimique n'a lieu (r=0) et pour lequel les facteurs d'équilibre sont la pression et la température (n=2) on obtient la relation :
Démonstration de la formule
Par définition, on a v = X − Y, où X est le nombre de paramètres intensifs et Y le nombre de relations.
Or, on a
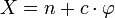 : il faut compter les variables intensives dont dépend le système (T et P, en général), ainsi que le nombre total de fractions molaires (il y en a c dans chaque phase).
: il faut compter les variables intensives dont dépend le système (T et P, en général), ainsi que le nombre total de fractions molaires (il y en a c dans chaque phase).De plus, on a
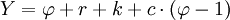 : on peut écrire pour chaque phase que la somme des quantités de matière des espèces en présente est égale à la quantité de matière totale ; il faut compter les équations chimiques indépendantes (correspondant à des équilibres entre espèces) ; il faut prendre en compte les relations imposées par l'expérimentateur ; il faut écrire les potentiels chimiques de chaque constituant.
: on peut écrire pour chaque phase que la somme des quantités de matière des espèces en présente est égale à la quantité de matière totale ; il faut compter les équations chimiques indépendantes (correspondant à des équilibres entre espèces) ; il faut prendre en compte les relations imposées par l'expérimentateur ; il faut écrire les potentiels chimiques de chaque constituant.Ainsi, on calcule
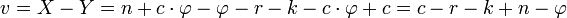 .
.- Portail de la chimie
- Portail de la physique
Catégories : Phase | Règle scientifique | Science des matériaux
Wikimedia Foundation. 2010.