- Potentiel hydrogène isoélectrique
-
Point isoélectrique
En Biologie, le point isoélectrique (pI) ou potentiel hydrogène isoélectrique (pHI) est le pH auquel une molécule est sous forme d'ion mixte ou, en physico-chimie, le pH d'une solution aqueuse dans laquelle un solide existe sous un potentiel électrique neutre.
En biologie
Le pHi ou pI d'une molécule (la plupart du temps une protéine ou un peptide) est défini comme étant le pH (potentiel hydrogène) pour lequel la charge globale de cette molécule est nulle ou, autrement dit, le pH pour lequel la molécule est électriquement neutre (forme zwitterionique ou ion mixte).
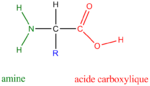
Cela ne signifie pas que la protéine ne possède aucun groupement chargé, c'est impossible de par sa composition d'acides aminés. En effet la structure d'un acide aminé :
correspond à une forme chimiquement inexistante : l'extrémité acide carboxylique sous forme
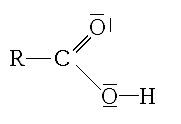 ne peut exister qu'à un pH où l'extrémité amine est sous forme
ne peut exister qu'à un pH où l'extrémité amine est sous forme 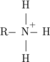 et inversement.
et inversement.Au pHi, la charge globale est donc nulle car les charges des extrémités N-terminale (amine) et C-terminale (acide carboxylique) ainsi que celle éventuellement présentes sur les chaînes latérales s'équilibrent.
- Si pH < pHi, la charge globale est positive, car la molécule a tendance à conserver ses protons ou à en capter du milieu acide.
- Si pH > pHi, la charge globale est négative, car la molécule a tendance à céder ses protons au milieu basique.
En physico-chimie
Selon Bolger, le caractère acide ou basique d'une surface s'exprime par son point isoélectrique " Is ou IEPS (Iso Electric point for the surface) " ou point de charge nulle " PCN ou PZC (Point of Zero Charge) ", défini comme étant le pH de la solution aqueuse dans laquelle le solide existe sous un potentiel électrique neutre. Si le pH de la solution est basique, la surface est acide, et inversement. La différence entre le PZC et l'IEPS est basée sur le phénomène d'adsorption spécifique. On peut considérer que si la grandeur mesurée ne dépend pas de la solution utilisée pour la mesurer (pH, concentration, nature des ions), alors on a affaire à un PZC. Dans le cas contraire, c'est un IEPS que l'on mesure. Par exemple, quand la mesure de goutte sessile à deux liquides est utilisée, on considère en général qu'il n'y a pas adsorption des ions de cette goutte et que la goutte déplace complètement l'alcane qui sert de deuxième liquide: on est alors en présence d’un PZC. Au contraire, dans les mesures de potentiel d'écoulement (streaming potential), la solution joue un rôle important et c'est un IEPS que l'on mesure. Enfin, la charge nette se définit grâce au pH de la solution aqueuse dans laquelle la surface métallique existe, dans un état électriquement neutre (c’est-à-dire [M-OH2+ surf]=[M-O- surf]) et au PZC.
- Si pH < PZC alors la charge nette est positive
- Si pH > PZC alors la charge nette est négative
Il existe plusieurs méthodes expérimentales permettant de décrire l’état acido-basique de la surface : la mesure du potentiel d’écoulement, la photoélectrochimie, la mesure de l’angle de contact, et la spectroscopie XPS.
Liens externes
- (fr) Le Point isoélectrique des acides aminées sur Chimie générale on-line
- (fr) Séparation des acides aminées par électrophorèse sur Chimie générale on-line
- (en) Le point isoélectrique - en ligne
- (en) EMBL WWW Gateway to Isoelectric Point Service
- Portail de la chimie
- Portail de la biochimie
Catégories : Propriété chimique | Acide aminé
Wikimedia Foundation. 2010.