- Mélange azéotropique
-
Azéotrope
Azéotrope ou azéotropique (a privatif, du grec zêin bouillir et tropos action de tourner). Se dit d'un mélange liquide qui bout à température fixe en gardant une composition fixe.
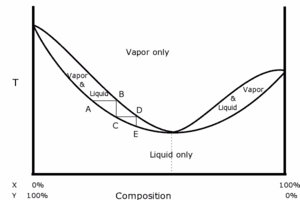
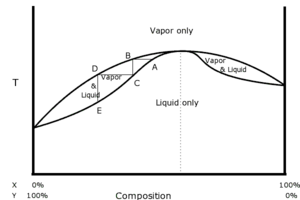
Quand on distille un mélange de deux liquides, la température d'ébullition n'est pas toujours comprise entre celles des deux constituants ; elle peut présenter un point d'ébullition supérieur au point d'ébullition des constituants purs (azéotropisme négatif) ou un point d'ébullition inférieur au point d'ébullition des constituants purs (azéotropisme positif). Dans l'un et l'autre des cas, la distillation fractionnée ne permet pas de séparer les deux liquides, mais seulement l'un d'entre eux et le mélange azéotrope correspondant au point d'ébullition maximal ou minimal.
Par exemple l'alcool à 96 ° (soit 96% d'éthanol et 4% d'eau) est un mélange azéotropique qui bout à 78,1 °C, température inférieure à celle de l'éthanol pur (Téb: 78,4 °C).
Toutefois, l'on obtient un point azéotrope dans un diagramme binaire, pour des solutions liquides miscibles non idéales. On parle alors de solutions réelles, où les interactions entre 2 constituants A1 et A2 sont de natures différentes des interactions de type A1↔A1 ou de type A2↔A2. Par exemple, un mélange binaire eau/éthanol.
On peut citer quelques propriétés du point azéotrope:
- Sa courbe d'analyse thermique est analogue à la courbe d'analyse thermique d'un corps pur.
- La composition de l'azéotrope varie avec la pression.
- Le théorème de Gibbs-Konovalov permet de démontrer qu'au point azéotropique, la fraction molaire xL liquide du composé A est égale à la fraction molaire xV vapeur du composé A, c’est-à-dire: xL(A) = xV(A).
- Portail de la chimie
Catégories : Chimie générale | Chimie analytique | Thermochimie
Wikimedia Foundation. 2010.