- Loi de kohlrausch
-
Loi de Kohlrausch
Cette loi a été établie en 1874 par Friedrich Kohlrausch.
La conductivité molaire ionique λi est une grandeur caractéristique d'un ion, c'est l'apport de l'ion à la conductivité électrique de la solution. Elle dépend notamment de la concentration, de la charge et de la taille de l'ion.
Chaque ion se comporte dans une solution diluée comme s'il était seul. C'est la loi de migration indépendante des ions. La conductivité de cet ion est donnée par :
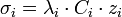 , avec zi le nombre de charges de l'ion (par exemple zi = 2 pour l'ion sulfate
, avec zi le nombre de charges de l'ion (par exemple zi = 2 pour l'ion sulfate 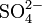 ).
).Pour une solution, les conductivités s'additionnent :
σ = ∑ σi i On donne souvent dans les tables la conductivité molaire ionique limite
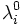 qui correspond à la conductivité molaire ionique extrapolée pour une dilution infinie.
qui correspond à la conductivité molaire ionique extrapolée pour une dilution infinie.Dans le cas d'un électrolyte fort, on peut appliquer la loi de Kohlrausch :
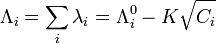
- Portail de la chimie
Catégorie : Loi en chimie
Wikimedia Foundation. 2010.
