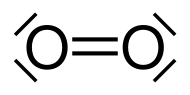- Dioxygène
-
 Pour les articles homonymes, voir O2 (homonymie).
Pour les articles homonymes, voir O2 (homonymie).Dioxygène 
Représentation du dioxygène Général Nom IUPAC dioxygène Synonymes oxygène No CAS No EINECS PubChem No E E948 SMILES InChI Apparence gaz incolore à température ambiante, gaz liquéfié ou liquide extrêmement froid incolore à bleu[1] Propriétés chimiques Formule brute O2 [Isomères] Masse molaire[2] 31,9988 ± 0,0006 g·mol-1
O 100 %,Diamètre moléculaire 0,292 nm Propriétés physiques T° fusion -219 °C[3] T° ébullition -183 °C[3] Solubilité dans l'eau à 20 °C : 3,1 ml/100 ml[1],
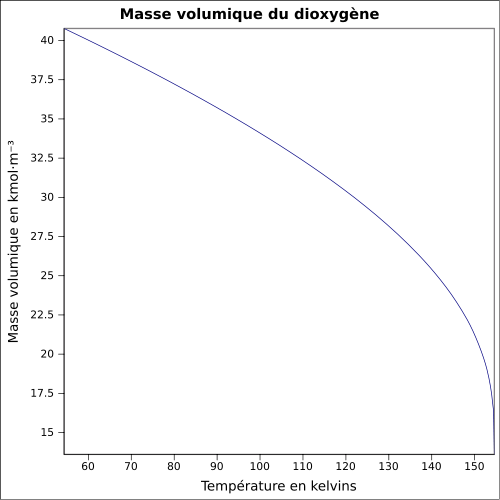
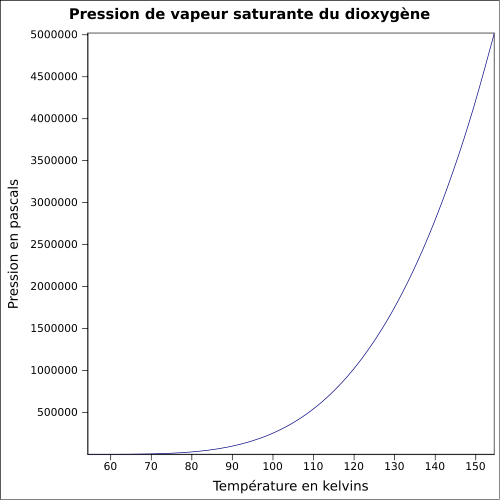
14,6 mg·l-1 (eau à 0 °C)Masse volumique Pression de vapeur saturante à -118 °C : 5 080 kPa[1] Point critique -118,67 °C
50,422 bar
0,6361 kg·l-1 [3]Point triple -218,7916 °C [5]
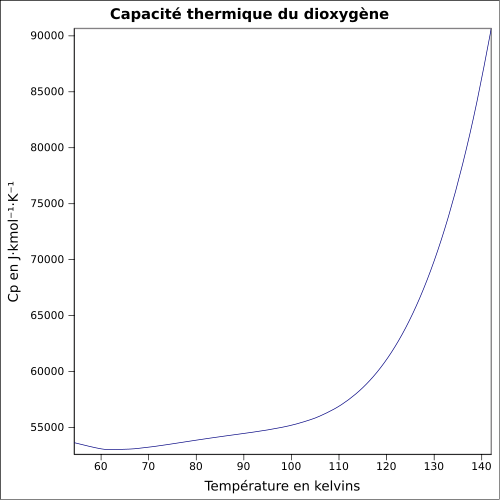
0,00149 bar [3]Vitesse du son 330 m·s-1 (27 °C,1 atm)[6] Thermochimie ΔfusH° 213 kJ/kg ΔvapH° 6,82 kJ·mol-1 (1 atm, -182,95 °C)[7] Cp Propriétés électroniques 1re énergie d'ionisation 12,0697 ± 0,0002 eV (gaz)[8] Précautions Directive 67/548/EEC 
OPhrases R : 8, Phrases S : 2, 17, Transport 25 1072
225 1073 NFPA 704 SIMDUT[9] 

SGH[10] 

DangerUnités du SI & CNTP, sauf indication contraire. Le dioxygène est une molécule composée de deux atomes d'oxygène, notée O2, qui est à l'état de gaz aux conditions normales de pression et de température.
Il a été découvert le 1er août 1774 par le chimiste anglais Joseph Priestley, et baptisé du nom d'« oxygène » par le chimiste français Antoine Lavoisier en 1778.
Il est également appelé « molécule d'oxygène », ou simplement « oxygène » dans le langage courant (à ne pas confondre avec l'élément chimique de même nom).
Il est incolore, inodore et insipide.
Il compose 20,95 % en volume et 23,2 % en masse de l'atmosphère terrestre. C'est un gaz indispensable à beaucoup de formes de vie, auxquelles il fournit l'oxygène nécessaire à la respiration des cellules. Il n'est en revanche pas indispensable à certaines bactéries dites anaérobies facultatives, et il est même mortel pour les bactéries anaérobies strictes.
Il participe au même titre que le dichlore à des réactions d'oxydo-réduction, essentiellement dans son cas à la combustion et la corrosion.
Dans l'environnement aquatique, l'oxygène dissous est une conditions nécessaire à la vie de très nombreuses espèces [11].
Sommaire
Origine
Plusieurs hypothèses ont été avancées pour expliquer la teneur de l'air en dioxygène :
- la plus communément retenue est qu'il s'agit du déchet produit par les cyanobactéries, et plus généralement des végétaux chlorophylliens, extrayant le carbone du dioxyde de carbone et rejetant l'oxygène (sous forme de dioxygène) par le mécanisme de la photosynthèse.
- une seconde concerne la décomposition dans la haute atmosphère depuis des milliards d'années, de molécules d'eau en dioxygène et dihydrogène, sous l'effet des rayonnements solaire et cosmique.
Les deux phénomènes existants, la réalité peut être une combinaison des deux processus.
Biologie
La respiration aérobie consiste à absorber le dioxygène nécessaire au catabolisme oxydatif et à l'apport d'énergie aux cellules. Les organismes ont une capacité limite d'absorption, appelée consommation maximale d'oxygène.
La consommation de dioxygène est un indice d'activité cellulaire. Cette remarque est à l'origine d'une caractérisation de la pollution biodégradable d'un échantillon d'eau, la demande biologique en oxygène.
Structure
Structure géométrique
La molécule est diatomique et la distance moyenne entre les deux atomes est 120,74 pm dans son état fondamental.
Dans ces deux premiers états excités (voir la partie spectroscopie ci-dessous), cette distance augmente à 121,55 pm dans le premier état et à 122,77 pm dans le deuxième.
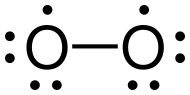
Représentation de Lewis
La représentation courante de Lewis du dioxygène, afin que ses deux atomes respectent la règle de l'octet, est une double liaison, chaque atome portant en outre deux doublets d'électrons non partagés. Cependant, cette structure ne rend pas compte du paramagnétisme de cette molécule. Il est possible de proposer un schéma de Lewis qui respecte cette observation expérimentale avec une liaison simple (et pas une liaison double) et un électron célibataire par atome d'oxygène.
La représentation peu classique, avec une simple liaison, présente l'inconvénient de ne pas rendre compte de la courte distance de liaison (d = 120,74 pm), bien plus courte qu'une liaison simple O-O comme dans le peroxyde d'hydrogène H-O-O-H pour lequel la longueur de liaison est 145,7 pm. Cela explique en particulier pourquoi, dans la pratique, cette structure n'est utilisée qu'à titre pédagogique, pour mettre l'accent sur le caractère diradicalaire de la molécule. Une description plus performante est obtenue avec les orbitales moléculaires.
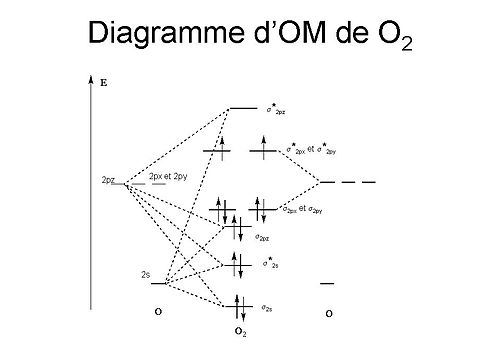
Diagramme d'orbitales moléculaires
Dans le cadre théorique des orbitales moléculaires (méthode CLOA), l'interaction entre deux atomes d'oxygène pour former une molécule se traduit par le diagramme ci-contre.
Les deux orbitales 2s des deux atomes d'oxygène, initialement de même énergie, subissent une dégénérescence, formant une orbitale σ2S liante et une orbitale σ*2S antiliante, toutes deux complètement occupées, ne résultant en aucune liaison entre les deux atomes. Les six orbitales 2p des deux atomes subissent elles aussi une dégénérescence, formant trois orbitale σ2px, σ2py, et σ2pz liantes et trois orbitale σ*2px, σ*2py, et σ*2pz liantes et σ*2px. Les huit (2*4) électrons 2p se répartissent selon :
- six électrons occupent les trois orbitales liantes de basse énergie
- les deux électrons restant occupent chacun une orbitale antiliante.
Cette combinaison d'orbitales 2p résulte donc en trois orbitales moléculaires liantes et une antiliante, soit une indice de liaison de 2. La répartition des deux électrons sur les deux orbitales antiliante explique aussi le caractère diradicalaire du dioxygène. Cette propriété d'être radicalaire alors que le nombre d'électrons de la molécules est pair est unique parmi les molécules diatomiques. Cette répartition explique aussi le caractère paramagnétique du dioxygène, ce que ne permet pas de présager sa représentation de Lewis « classique ».
Ce statut d'état triplet confère à la molécule des propriétés magnétiques (voir ci-dessous) et peut être rendu responsable de son inertie chimique à température ambiante. En effet, la réaction de O2 avec une autre molécule (H2, molécules organiques) qui est presque toujours dans un état singulet pour former une molécule en état singulet se déroule sans la conservation du spin total ; c'est la cause d'une grande lenteur des réactions chimiques impliquant le dioxygène à température et pression ordinaire.
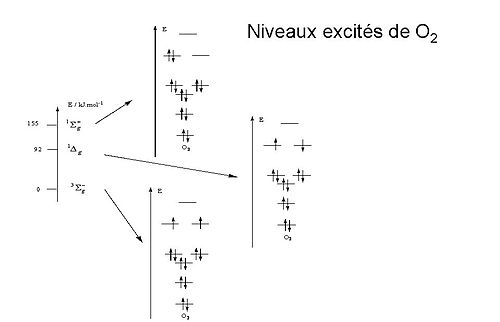
Spectroscopie
Les deux premiers niveaux excités du dioxygène sont deux états singulets à 15 800 cm-1 (94,72 kJ.mol-1) et 21 100 cm-1 (157,85 kJ.mol-1) (voir diagramme). Ces transitions sont interdites de spin, ce qui conduit à ce que le dioxygène soit incolore. C'est le cas en phase gazeuse, la couleur bleue de l'atmosphère étant due à la diffusion Rayleigh[12].
La couleur bleue à l'état liquide (voir ci-dessous) résulte de l'absorption de deux photons à 7 918 cm-1 sur une association de deux molécules de dioxygène (dimère O4).
Magnétisme
Le dioxygène est paramagnétique, propriété observée par Faraday dès 1848[12]. Le diagramme d'orbitale moléculaire du dioxygène tracé par la méthode CLOA en rend compte. Ce diagramme présente en effet deux électrons célibataires sur les deux orbitales Π*.
Une espèce du dioxygène diamagnétique peut être produite par réaction entre le peroxyde d'hydrogène et l'ion hypochlorite ou par transfert d'énergie depuis une molécule excitée photoniquement vers le dioxygène. Il est appelée oxygène singulet (le dioxygène paramagnétique est triplet). Cette forme instable et très réactive de dioxygène comporte une double liaison entre les atomes d'oxygène.
Production
Production industrielle
Le dioxygène est obtenu de manière industrielle principalement (à 95 %) par séparation cryogénique des composés de l'air, c'est-à-dire par une liquéfaction de l'air suivie d'une distillation fractionnée.
Les températures critiques du diazote N2 (tc = -146,9 °C) et du dioxygène O2 (tc = -118,4 °C) ne permettent pas la liquéfaction de l'air par simple compression. L'air doit donc être comprimé entre 5 et 7 bar, puis filtré, séché, décarbonaté par adsorption sur tamis moléculaire et enfin refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par une détente de 5 à 10 % du débit gazeux traité, dans une turbine dont le travail extérieur est récupérable.
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d'obtenir, en continu, des gaz purs. La première colonne (moyenne pression, 5 bar) réalise une première séparation de l'air en diazote gazeux pur (à 99,999 %) au sommet et un liquide riche en dioxygène (environ 40 %), à la base. Ce liquide est alors envoyé à mi-hauteur de la deuxième colonne de distillation (basse pression, 1,3 bar). Le dioxygène O2 entre 99,5 % et 99,7 % est récupéré à la base de cette deuxième colonne. Il contient moins de 1 ppm de diazote, la principale impureté est l'argon.
Les colonnes de distillation ont entre 1 et 6 m de diamètre, et mesurent de 15 à 25 m de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L'isolation thermique est réalisée avec de la perlite (sable de silice expansé). Le maintien en température des colonnes ne consomme que 6 à 7 % de l'énergie totale dépensée.
La consommation en énergie est de 0,4 kWh⋅m-3 de dioxygène O2 gazeux, soit de 50 à 60 % du prix de revient.
 Par pure coïncidence, le dioxygène liquide a une couleur semblable à celle du ciel.
Par pure coïncidence, le dioxygène liquide a une couleur semblable à celle du ciel.
Toutefois, les deux phénomènes sont totalement indépendants : le bleu du ciel est dû à la diffusion Rayleigh, celui du dioxygène liquide vient de l'absorption de la lumière rouge.Environ 5 % du dioxygène industriel est produit par un autre procédé, non cryogénique, appelé VPSA (Vacuum Pressure Swing Adsorption) ou adsorption par alternance de pression et de vide.
L'air ambiant est séché et épuré par filtration, puis passe dans une colonne de zéolithes qui adsorbent plus rapidement le diazote N2 que le dioxygène O2. Les zéolites peuvent fixer 10 litres de diazote par kilogramme. Lorsqu'elles sont saturées, l'air est envoyé sur une seconde colonne, pendant que le diazote de la première colonne désorbe sous vide. La pureté du dioxygène obtenu ainsi par élimination du diazote de l'air peut atteindre 90 à 95 %. Ce dioxygène contient encore 4,5 % d'argon qui comme le dioxygène n'est pas adsorbé. La consommation d'énergie est de 0,4 à 0,5 kWh⋅m-3 de dioxygène. Cette méthode est de plus en plus employée dans les procédés industriels dont les besoins sont inférieurs à 100 tonnes/jour, ainsi que dans les respirateurs utilisés à domicile.
L'oxygène produit est transporté :
- sous forme liquide ou gazeuse par des canalisations appelées oxyducs ou oxygénoducs ;
- sous forme gazeuse comprimée dans des bouteilles ou réservoirs en acier à 200 bar ;
- sous forme liquide, en camions citernes.
En 1995, huit compagnies dans le monde fabriquaient la quasi totalité de l'oxygène industriel :
- Air liquide (France) : 17 %
- BOC (Royaume-Uni) : 14 % (racheté par Linde en 2006)
- Praxair (États-Unis) : 14 %
- Air Products (États-Unis) : 8 %
- Nippon Sanso (Japon) : 7 %
- AGA (Suède) : 7 % (racheté par Linde en 2000)
- Messer (Allemagne) : 6 %
- Linde (Allemagne) : 6 %
Les principaux pays producteurs en 1996, étaient :
- États-Unis : 27 millions de tonnes
- Japon : 12,7 millions de tonnes
- France : 3,23 millions de tonnes
Dans le monde, la production totale était de l'ordre de 100 millions de tonnes en 1996, soit 1⁄10 millionième du dioxygène de l'atmosphère.
Au laboratoire
Le dioxygène a longtemps été préparé en petite quantité, au laboratoire, par réaction de l'oxylithe Na2O2 avec l'eau.
Il peut être préparé par électrolyse de l'eau pour des démonstrations pédagogiques, mais cette technique est lente et couteuse en énergie.
Il peut également être produit par la décomposition catalytique de l'eau oxygénée en présence d'oxyde de manganèse(IV) MnO2.
Réactivité
Le dioxygène est thermodynamiquement très réactif, et la plupart de ses réactions sont fortement exothermiques. Cette grande réactivité n'a généralement pas lieu à température ambiante. Les raisons cinétiques ont été détaillées ci-dessus.
Avec les corps simples
Peu de corps simples ne se combinent pas directement avec le dioxygène : le tungstène W, le platine Pt, l'or Au et les gaz nobles. Il faut noter que des composés oxygénés de gaz nobles existent cependant (XeO3), mais ils n'ont jamais pu être obtenus par action directe avec O2.
Le fait que les oxydes existent pour quasiment tous les éléments a largement aidé Mendeleïev à classer les éléments chimiques (1869). Par ailleurs, le fait que certains éléments chimiques possèdent plusieurs oxydes distincts (par exemple l'azote) a été à l'origine de l'émergence la notion d'atome par Dalton (1800).
Les ions de O2
De nombreux ions de O2 sont connus :
- O2+, dans de rares composés ;
- O2-, ion superoxyde, fréquent dans les systèmes biologiques pour lesquels l'oxydoréduction est souvent monoélectronique ; c'est une entité peu stable ;
- O22-, ion peroxyde, fréquent dans les peroxydes métalliques comme BaO2 ; l'oxygène y a le même degré d'oxydation que dans le peroxyde d'hydrogène H2O2.
Réaction du dioxygène singulet 1O2
Le dioxygène singulet est produit par irradiation lumineuse de dioxygène triplet (son état fondamental) 3O2 avec un photosensibilisateur. Il faut pour cela que l'état excité de ce dernier soit supérieur à 94,7 kJ.mol-1 (voir ci-dessus la partie spectroscopie).
- 3O2 + 1Sensibilisateur —hModèle:Grec→ 1O2 + 3Sensibilisateur
Le dioxygène singulet peut aussi être produit chimiquement, par exemple en solution alcoolique, avec un mélange d'eau oxygénée et d'eau de Javel[13] :
- H2O2 + ClO- → Cl- + H2O + 1O2
L'oxygène singulet est très réactif, tant chimiquement que biologiquement.
Utilisations[14]
Le dioxygène, dans l'air, est utilisé pour les combustions (chauffage, transport).
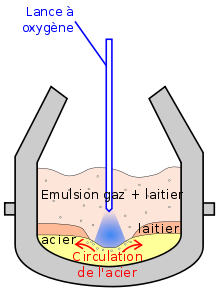
Séparé du diazote, son principal usage est la sidérurgie. Le fer, en sortie des hauts-fourneaux est sous forme de carbure Fe3C, inutilisable car contenant plus de 4% en masse de carbone. Ce carbone est brulé par injection d'oxygène directement dans le fer fondu. C'est le principe des convertisseurs. Il faut 60 m3 CNTP de O2 par tonne de fer. La consommation d'un site sidérurgique se chiffre en milliers de tonnes de O2 par jour.
La pétrochimie est également une consommatrice gourmande quand il est question de produire de l'oxyde d'éthylène, de l'oxyde de propylène, de chlorure de vinyle par oxychloration, dans le raffinage des produits pétroliers, pour régénérer des catalyseurs...
D'autres procédés nécessitent également de gros tonnages de dioxygène :
- la synthèse du dioxyde de titane par le procédé au dichlore ;
- le blanchiment de la pâte à papier, ce qui limite la consommation en dichlore Cl2 qui reste l'agent de blanchiment principal ;
- le retraitement de certains déchets chimiques par exemple, les déchets soufrés issus de la production de méthacrylate de méthyle ce qui conduit à la récupération de H2SO4;
Les autres usages ponctuels sont par exemple :
- la production de flammes à haute température, comme celle du chalumeau oxhydrique ;
- Comme gaz médical :
- oxygénothérapie normobare (à pression atmosphérique) : dans l'assistance respiratoire de personne ayant des difficultés respiratoires (maladie telle que l'asthme ou l'insuffisance respiratoire chronique, ou lors d'une anesthésie), pour la ventilation artificielle (arrêt de la respiration);
- oxygénothérapie hyperbare (à haute pression) : pour le traitement de certaines intoxications au gaz (notamment au monoxyde de carbone), des accidents de décompression en plongée ou de certaines brûlures, de certaines pathologies artéritiques.
Références
- OXYGENE et OXYGENE (LIQUEFIED), fiches de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultées le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 7782-44-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 janvier 2009 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « Oxygène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- oxygène dissous University of Wisconsin. (2006). Dissolved oxygen:aquatic life depends on it. Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series. Availableat http://watermonitoring.uwex.edu/pdf/level1/FactSeries-DissolvedOxygen.pdf (accessed 25 February2010)
- Greenwood N.N. & Earnshaw A. (1997). Chemistry of the Elements. 2e Ed. Elsevier. p. 606.
- Greenwood N.N. & Earnshaw A. (1997). Chemistry of the Elements, 2e Ed. Elsevier, p.615.
- Vigne J.-L. Données industrielles.
Articles liés
- Portail de la chimie
- Portail de la médecine
- Portail de l’alimentation et de la gastronomie
Catégories :- Produit chimique comburant
- Composé de l'oxygène
- Gaz inorganique
- Anesthésie-Réanimation
- Oxygène
Wikimedia Foundation. 2010.