- Acide trifluorométhanesulfonique
-
Acide trifluorométhanesulfonique 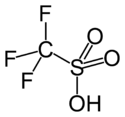
Structure de l'acide triflique.Général Nom IUPAC Acide trifluorométhanesulfonique Synonymes Acide triflique No CAS No EINECS SMILES InChI Apparence liquide limpide Propriétés chimiques Formule brute CF3SO3H Masse molaire[1] 150,077 ± 0,007 g·mol-1
C 8 %, H 0,67 %, F 37,98 %, O 31,98 %, S 21,37 %,pKa -14,9 Propriétés physiques T° fusion -40,15 °C sous 1 bar T° ébullition 161,85 °C sous 1 bar Solubilité soluble à 20 °C dans l'eau Masse volumique 1,71 (20 °C) Point d’éclair Non inflammable Pression de vapeur saturante 10 hPa (55 °C) Précautions Directive 67/548/EEC[2] 
CPhrases R : 22, 34, 37, Phrases S : 26, 30, 36/37/39, 45, Transport[2] 88 3265
80 3265 SIMDUT[3] 
SGH[2] 
AttentionÉcotoxicologie DL50 1 605 mg·kg-1 Composés apparentés Anions apparentés FSO3H
H2SO4Autres composés CF3SO3Li
CF3SO3Na
CF3SO3KUnités du SI & CNTP, sauf indication contraire. L'acide trifluorométhanesulfonique (connu également sous le nom d'acide triflique et parfois désigné par la formulation TfOH) est un type d'acide sulfonique de formule : CF3SO3H. Il est parfois considéré comme un des plus puissants acides, et fait partie de ceux qualifiés de « superacides ». Il est environ 1000 fois plus puissant que l'acide sulfurique. L'acide triflique est largement utilisé comme catalyseur et précurseur en chimie organique[4],[5].
Sommaire
Propriétés
L'acide triflique est un liquide incolore et hygroscopique à température ambiante. Il est soluble dans un solvant polaire comme le DMF, le DMSO, l'acétonitrile ou encore le diméthylsulfone. Cependant, son addition à ces solvants polaires peut être dangereusement exothermique.
Avec un Ka égal à 8,0.1014 mol.kg-1, le TfOH s'avère être un superacide. L'acide triflique doit ses propriétés utiles à ses grandes stabilités thermique et chimique. L'acide et sa base conjuguée CF3SO3-, connue sous le nom de triflate, résistent aux réactions d'oxydo-réduction, alors que de nombreux acides forts sont oxydants, comme HClO4 et HNO3. L'anion triflate est non-réactif aux attaques de nucléophiles, même puissants. En raison de sa résistance à l'oxydation et à la réduction, l'acide triflique constitue un réactif à la fois utile et versatile. De plus, l'acide triflique ne sulfonate pas les substrats, ce qui constitue un problème avec un acide sulfurique, l'acide fluorosulfurique et l'acide chlorosulfurique. Ci-dessous est écrite une sulfonation prototype, que le TfOH ne supporte pas :- C6H6 + H2SO4 → C6H5(SO3H) + H2O
L'acide triflique fume dans un air humide et forme un monohydrate solide stable, (CF3SO3H, H2O), dont le point de fusion est à 34 °C.
Historique et synthèses
L'acide trifluorométhanesulfonique fut synthétisé pour la première fois en 1954 par Haszeldine et Kidd au moyen de la réaction[4]:
Une des autres possibilités de synthèse de l'acide triflique est la fluoration électrochimique (ou ECF pour electrochemical fluorination)[4]:
La synthèse industrielle implique une hydrolyse de CF3SO2F, suivie d'une acidification. L'acide triflique est purifié par la suite par distillation avec une faible quantité de Tf2O.
Utilisations
L'acide triflique est très utilisé dans les protonations, sa base conjuguée ne réagissant pas avec les autres réactifs.
Formation de sels
L'acide trifluorométanesulfonique réagit de manière exothermique avec les carbonates et les hydroxydes de métaux. La synthèse du Cu(OTf)2[4] est assez illustrative :
- CuCO3 + 2 CF3SO3H → Cu(O3SCF3)2 + H2O + CO2
La conversion des chlorocomplexes en triflates correspondants est plus intéressante pour le chimiste en synthèse, comme par exemple celle de [Co(NH3)5OTf]2+:
- 3 CF3SO3H + [Co(NH3)5Cl]Cl2 → [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl
Cette conversion est faite dans du TfOH à 100 °C, puis est suivie par la précipitation du sel par addition d'éther.
Réactions organiques
L'acide triflique réagit avec les halogénures d'acyles pour donner des anhydrides mixtes, lesquels sont des agents puissants d'acylation, comme dans la réaction de Friedel-Crafts[4] :
- CH3C(O)Cl + CF3SO3H → CH3C(O)OSO2CF3 + HCl
- CH3C(O)OSO2CF3 + C6H6 → CH3C(O)C6H5 + CF3SO3H
L'acide triflique catalyse la réaction des composés aromatiques avec les chlorures de sulfonyle, probablement aussi par l'intermédiaire d'un anhydride mixte[4].
Une réaction très similaire existe si l'on souhaite effectuer une polymérisation avec une synthèse utilisant l'acide triflique. Il existe d'autres réactions de type Friedel-Crafts utilisant l'acide triflique comme le craquage des alcanes ou l'alkylation des alcènes, très importantes dans l'industrie pétrolière. Ces catalyseurs dérivés de l'acide triflique sont très efficaces dans l'isomérisation d'hydrocarbures à chaînes droites ou faiblement ramifiées, accroissant de fait le taux d'octane de carburants pétroliers particuliers.
L'acide triflique réagit exothermiquement avec les alcools pour produire des éthers et des oléfines[4]. Il peut être utilisé comme catalyseur pour la condensation des alcools et des acides carboxyliques.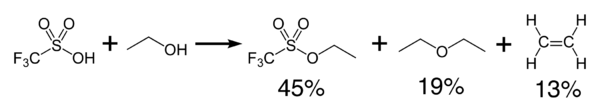
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trifluoromethanesulfonic acid » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Trifluoromethanesulfonic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
- « Acide trifluorométhanesulfonique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Howells, R. D., McCown, J. D. "Trifluoromethanesulfonic Acid and Derivatives." Chemical Reviews, 1977. Vol. 77, pp 69 - 92; DOI: 10.1021/cr60305a005
- Lakshminarayanapuram, R. S. "Trifluoromethanesulfonic Acid". Encyclopedia of Reagents for Organic Synthesis. 2001 John Wiley & Sons, Ltd. DOI: 10.1002/047084289X.rt246
Voir aussi
Dixon, N. E.; Lawrance, G. A.; Lay, P. A.; Sargeson, A. M.; Taube, H. "Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes" Inorganic Syntheses (1990), vol. 28, pp. 70-6.
- Fiche sécurité Fischer Sigma Aldrich
- Liste d'acides
Catégories :- Produit chimique corrosif
- Acide sulfonique
- Composé trifluorométhylé
- Superacide
- Réactif pour la chimie organique
Wikimedia Foundation. 2010.



