- Borane
-
Borane 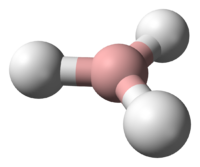
Général No CAS PubChem SMILES InChI Propriétés chimiques Formule brute BH3 Masse molaire[1] 13,835 ± 0,007 g·mol-1
H 21,86 %, B 78,14 %,Propriétés électroniques 1re énergie d'ionisation 12,026 ± 0,024 eV (gaz)[2] Unités du SI & CNTP, sauf indication contraire. En chimie, un borane est une molécule composé d'atomes de bore et d'hydrogène. Les boranes comprennent un grand groupe de molécule qui ont comme formule générale BxHy. Ces molécules ne sont pas présentes à l'état naturel. Beaucoup de boranes s'oxydent facilement au contact de l'air, certains d'une manière violente. Le membre parent BH3 est appelé borane, mais il est uniquement connu dans son état gazeux, et dimérise pour former du diborane, B2H6. Les boranes plus gros sont tous constitués d'agrégats de bore polyèdriques dont certains existent sous forme d'isomères. Par exemple, les isomères de B20H6 sont basés sur la fusion de 2 agrégats de 10 atomes.
Les boranes les plus importants sont le diborane B2H6, le pentaborane B5H9 et le décaborane B10H14.
Le développement de la chimie des hydrures de bore conduit à de nouvelles techniques expérimentales et des concepts théoriques. Les hydrures de bore ont été étudiés en tant que combustibles potentiels pour les fusées et les automobiles.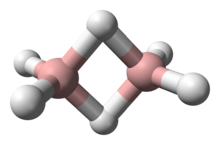 Le BH3 dimérise en diborane B2H6.
Le BH3 dimérise en diborane B2H6.
Au cours des dernières décennies, le champ d'application de la chimie des hydrures de bore a grandi pour inclure des boranes contenant d'autres atomes que le bore, comme le carbone dans les carboranes et les métaux dans les métallaboranes dans lesquels un ou plusieurs atomes de bore sont remplacés par des atomes de métaux.
Sommaire
Formule générique des boranes
Les 4 types de boranes en un agrégat ont les formules génériques suivantes, où "n" et le nombre d'atomes de bore :
Type formule notes closo− BnHn2− Aucun boranes BnHn+2 neutres sont connus nido− BnHn+4 arachno− BnHn+6 hypho− BnHn+8 seulement des adduits Il existe également une série d'hypercloso-boranes neutres qui ont pour formule théorique BnHn; par exemple B12(OCH2Ph)12, qui est un dérivé d' hypercloso-B12H12[3]..
Nomenclature
Le nommage des boranes neutres est illustré par les exemples suivants, où le préfixe grec indique le nombre d'atomes de bore et le nombre d'atomes d'hydrogène est entre parenthèses :
- B5H9 pentaborane(9)
- B6H12 hexaborane(12)
Le nommage des anions est illustré ci-dessous, où le nombre d'hydrogènes est d'abord précisé, puis le nombre de bores et enfin la charge totale entre parenthèses :
- B5H8− octahydropentaborate(1−)
Parfois closo− nido− etc (voir ci-dessus) peut être ajouté:-- B5H9, nido−pentaborane(9)
- B4H10, arachno−tetraborane(10)
- B6H62−, hexahydro−closo−hexaborate(2−)
Naturellement de nombreux composés ont un nom commun abrégé.
Types d'agrégats
On réalisa au début des années 1970 que la géométrie des agrégats de bore sont liées et qu'elles se rapprochent du deltaèdre ou du deltaèdre avec un ou plusieurs sommets manquants. Les deltaèdres que l'on retrouve dans la chimie du borane sont (en utilisant les noms utilisés par la plupart des chimistes) :
Deltaèdre Sommets Bipyramide trigonale 5 Octaèdre 6 Bipyramide pentagonale 7 Dodécaèdre (voir Disphénoïde adouci) 8 Prisme trigonal à 3 faces coiffées 9 Antiprisme carré à 2 faces coiffées 10 Octadécaèdre 11 Icosaèdre 12 Une particularité de ces deltaèdres est que les atomes de brome aux sommets peuvent avoir un différent nombre d'atomes de bore comme proches voisins. Par exemple, dans la bipyramide pentagonale, 2 bores ont 3 voisins, 3 bores ont 4 voisins alors que l'agrégat octaédral tous les sommets sont les mêmes, chaque bore a 4 voisins. Ces différences entre les atomes de bore à différentes positions sont importantes dans la détermination de la structure car ils ont différents déplacements chimiques dans les spectres RMN.
B6H10 est un exemple typique. Sa géométrie est essentiellement une structure de 7 bores (bipyramide pentagonale), où il manque un sommet qui avait le plus grand nombre de proches voisins, par exemple un sommet avec 5 voisins. Les atomes d'hydrogène forment un pont hydrogène sur la face ouverte. Une exception notable à ce modèle général est B8H12 : l'octaborane(12) devrait avoir une géométrie de type nido- (basée sur B9H92- auquel il manque un sommet), mais elle est similaire à la géométrie de B8H14, qui est basée sur B10H102-.
Les noms pour les séries de boranes sont dérivés de ce modèle général pour les géométries d'agrégats :
- hypercloso- (du grec for "sur la cage") un agrégat complet fermé, ex. B8Cl8 est un dodécaèdre légèrement déformé
- closo- (du grec pour "cage") un agrégat complet fermé, ex. l'icosaèdral B12H122−
- nido- (du latin pour "nest") B occupe n sommets d'un n+1 deltaèdre, ex. B5H9 un octaèdre qui a perdu un sommet
- arachno- (du grec pour "toile d'araignée") B occupe n sommets d'un n+2 deltaèdre ex, B4H10 un octaèdre qui a perdu 2 sommets
- hypho- (du grec pour "filet") B occupe n sommets d'un n+3 deltaèdre peut-être B8H16 a cette structure, un octaèdre qui a perdu 3 sommets
- conjuncto- 2 ou plus exemples ci-dessus ont fusionné ensemble
Liaisons des boranes
Les boranes ont une carence en électrons et posent un problème pour la définition conventionnelle de la liaison covalente qui implique un partage d'une paire d'électrons. BH3 est une molécule triangulaire plane (symétrie moléculaire D3h ). Le diborane a une structure basé sur des ponts hydrogènes (voir l'article diborane). La description des liaisons dans les plus gros boranes énoncés par William Lipscomb implique :
- Des liaisons à trois centres et deux électrons (ponts hydrogènes)
- Des liaisons à trois centres et deux électrons B-B-B
- Des liaisons à deux centres et deux électrons (dans B-B, B-H et BH2)
Le nombre de Styx a été introduit pour aider au comptage d'électrons où s = nombre de liaisons à 3 centres B-H-B; t= nombre de liaisons à 3 centres B-B-B; y = nombre de liaisons à 2 centres B-B et x = nombre de groupes BH2
La méthodologie de Lipscomb a largement été remplacé par une approche d'orbitale moléculaire. Ces résultats ont été résumés dans une règle simple et puissante, PSEPT (Polyhedral skeletal electron pair theory), aussi connu sous le nom de règle de Wade. Cela peut être utilisé pour prédire le type d'agrégat, closo-, nido-, etc. La puissance de cette règle est sa facilité et son application à beaucoup de types d'agrégats autres que les boranes. Les chimistes théoriques continuent leurs efforts pour développer le traitement des liaisons des boranes -, un exemple est le modèle de Stone des harmoniques de tenseurs de surface. Un développement récent est la liaison à 4 centres et 2 électrons.
Chimie des boranes
Propriétés et stabilité
Les boranes sont tous incolores et diamagnétiques. Ce sont des réactifs et certains sont pyrophoriques. La majorité sont très toxiques et nécessitent des précautions particulières.
- closo−
- Il n'y a pas de borane closo neutre connu. Les sels d'anions closo, BnHn2− sont stables dans une solution aqueuse neutre, et leur stabilité augmente avec la taille. Le K2B12H12 is stable jusqu'à 700o.
- nido−
- le Pentaborane(9) et leDécaborane(14) sont les plus stables nido−boranes, contrairement au nido−B8H12 qui se décompose au-dessus de -35o.
- arachno−
- Généralement ils sont plus réactifs que les nido−boranes, et encore les boranes plus gros tendent à être plus stables.
Synthèse et réactivité
Borane BH3 C'est un important intermédiaire dans la pyrolyse du diborane pour produire des boranes plus grands.
Diborane B2H6 et boranes plus grands' Le diborane est produit industriellement par la réduction de trifluorure de bore et est le point de départ pour produire les boranes plus grands. Il a été longuement étudié.
Réactivité Les réactions typiques des boranes sont
- la substitution électrophilique
- la substitution nucléophilique par des bases de Lewis
- la déprotonation par des bases fortes
- des réactions de constructions d'agrégat avec des borohydrides
- une réaction d'un nido−borane avec un alcyne pour donner un agrégat carborane.
Les boranes peuvent être ligands dans des complexes. Les hapticités η1 à η6 ont été trouvées, avec la donation d'un électron impliquant des ponts hydrogènes ou la donation à partir des liaisons B-B. Par exemple, nido−B6H10 peut remplacer l'éthylène dans le sel de Zeise pour produire du Fe(η2-B6H10)(CO)4.
Les boranes peuvent réagir pour former des hétéro-boranes, par exemple des carboranes ou des métalloboranes.
Histoire
Le développement de la chimie des boranes a posé 2 défis aux chimistes. Premièrement, les nouvelles techniques de laboratoire devaient être développées pour gérer ces composés très réactifs; deuxièmement les structures de ces composants défiaient les théories admises des liaisons chimiques. Le chimiste allemand Alfred Stock caractérisa en premier la série des composés bore-hydrogène. Son équipe développa l'appareillage pour les hauts vides et les techniques pour gérer ces composants. Cependant, l'exposition au mercure (utilisé notamment dans les pompes à diffusion de mercure) fit que Stock développa un empoisonnement au mercure. Empoisonnement sur lequel il a écrit les premiers articles scientifiques. Lipscomb et ses assistants travaillèrent sur les liaisons des agrégats. Lipscomb reçut le prix Nobel de chimie en 1976 pour ce travail.
L'intérêt pour les boranes augmenta durant le Seconde Guerre mondiale en raison du potentiel du borohydride d'uranium pour l'enrichissement des isotopes d'uranium. Aux États-Unis, une équipe menée par Schlesinger développa la chimie basique des hydrides de bore et des hydrures d'aluminium connexes. Bien que le borohydride d'uranium n'était pas utilisé pour la séparation isotopique, le travail de Schlesinger a jeté les bases pour une foule de réactifs à l'hydride de bore pour la synthèse organique, dont la plupart ont été développés par son étudiant Herbert C. Brown. Les réactifs à base de borane sont maintenant largement utilisés en synthèse organique. Par exemple, le Tétrahydruroborate de sodium est le réactif standard pour convertir les aldéhydes et les cétones en alcools. Brown a reçu le prix Nobel de chimie en 1979 pour ce travail[4]. Dans les années 1950 et le début des années 1960, les États-Unis et l'URSS firent des recherches sur les hydrides de brome comme carburant à haute énergie (les éthylboranes, par exemple) pour les avions à grande vitesse comme le North American XB-70 Valkyrie. Le développement de missiles surface-air de pointe a fait la redondance des avions rapides, et les programmes de carburant ont été abandonnés, bien que le triéthylborane (TEB) a ensuite été allumer les moteurs du Lockheed SR-71 Blackbird [5].
Voir aussi
Références
- (en) Fox M.A., Wade K. Pure Appl. Chem. (2003), 75,9, 1315
- (en) Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, (ISBN 0080379419)
- (en) Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, (ISBN 0-471-19957-5)
Articles connexes
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- (en) Peymann T., Knobler C.B.,Khan S.I., Hawthorne M.F. Angew. Chemie Intnl Ed.(2001) 40,9,1664
- (en) Brown, H. C. “Organic Syntheses via Boranes” John Wiley & Sons, Inc. New York: 1975. ISBN 0-471-11280-1.
- (en) http://incolor.inebraska.com/hwolfe/history/sr71.pdf
Catégories :- Composé du bore
- Hydrure
Wikimedia Foundation. 2010.