- Ethylene
-
Éthylène
Éthylène 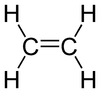
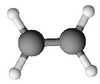
Formule brute et représentation 3D de l'éthylène Général Synonymes éthène No CAS No EINECS SMILES InChI Apparence gaz comprimé incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C2H4 [Isomères] Masse molaire 28,0532 g∙mol-1
C 85,63 %, H 14,37 %,Propriétés physiques T° fusion -169,2 °C[1] T° ébullition -104 °C[1] Solubilité dans l'eau : nulle[1] T° d’auto-inflammation 490 °C[1] Point d’éclair gaz inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.7-36.0[1] Pression de vapeur saturante à 15 °C : 8100 kPa[1] Précautions Directive 67/548/EEC 
F+Phrases R : 12, 67, Phrases S : (2), 9, 16, 33, 46, Transport 23 1962
223 1038 SIMDUT[3] 


SGH[4] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Unités du SI & CNTP, sauf indication contraire. L'éthylène, est un hydrocarbure insaturé. On peut aussi le trouver sous l'appellation R1150.
Sommaire
Chimie
C'est une espèce chimique
Propriétés
Propriétés physiques
L'éthène (éthylène) est le plus simple des alcènes.
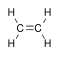
Formule de l'éthylène brute : C2H4 semi-développée : CH2=CH2 développée : représenté généralement
par une double liaison :C'est un gaz incolore, volatil, de densité proche de l'air avec lequel il forme des mélanges explosifs. À partir de 425 °C, il s'enflamme et brûle avec une flamme claire.(chaleur de combustion: 47 200 kJ/kg).
Propriétés chimiques
C'est un gaz très réactif.
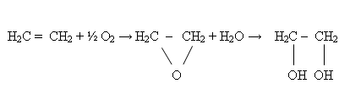
L'éthylène peut être hydraté en éthanol par addition d'une molécule d'eau en milieu acide.
H2C = CH2 + H2O ⇒ H3C - CH2OH
par halogénation, l'éthylène conduit au dibromoéthane.
H2C = CH2 + Br2 ⇒ BrH2C - CH2Br
L'éthylène est hydroxylé en 1,2-éthanediol (glycol) en présence de catalyseurs.
La polymérisation de l'éthylène en polyéthylène s'effectue en présence d'un catalyseur par un processus radicalaire.
Production
Dans l'industrie pétrochimique, l'éthylène est obtenu:
- à partir de gaz naturel riche en éthane (USA) par pyrolyse ou craquage à température élevée: Dans ce procédé, la proportion d'éthylène dans le mélange gazeux résultant est environ 45%.
- à partir du naphta provenant de la distillation fractionnée du pétrole (Europe) par vapocraquage. La proportion d'éthylène dans le mélange obtenu est d'environ 25%.
Les sous-produits gazeux obtenus sont: le dihydrogène, le méthane, l'acétylène, l'éthane, le propadiène, le propène. Ces gaz sont ensuite séparés.
Utilisations
L'éthylène est à la base d'un grand nombre de molécules dans l'industrie chimique. Avec ses dérivés immédiats, il est à la source d'un grand nombre de polymères et de matières plastiques.
Les produits issus de l'éthylène sont entre autres : le chlorure de vinyle, l'éthylbenzène, l'oxyde d'éthylène, l'éthanol (ou alcool éthylique),
Le monomère peut être utilisé directement pour produire du polyéthylène.
Le chlorure de vinyle est polymérisé en polychlorure de vinyle (PVC), matière plastique bien connue, et l'une des plus anciennes.
L'éthylbenzène donne deux produits: du styrène et du caoutchouc SBR.
Le styrène est polymérisé en polystyrène, avec lequel on produit du polystyrène expansé ou des matières plastiques.
Du caoutchouc SBR on obtient du caoutchouc résines ; l'oxyde d'éthylène ((CH2)2O) donne de l'éthylène glycol, qui lui-même, combiné à l'acide téréphtalique fournira des fibres polyesters,
L'éthanol peut être utilisé comme simple solvant.
L'oxyde d'éthylène ((CH2)2O)est un produit très instable à cause de «l'insaturation» de sa structure chimique et explose immédiatement en présence d'oxygène, c’est-à-dire il cherche à combler le vide atomique de sa structure en captant les atomes d'oxygène de l'air. En 1957, un réacteur pilote d'oxyde d'éthylène a explosé à Anvers (Belgique) faisant plusieurs morts et le souffle de l'explosion a déplacé un spectromètre de masse (de plus de cent tonnes) de plusieurs dizaines de mètres. L'éthylène glycol sert également dans la fabrication des antigels.
Le PTFE (PolyTétra-Fluoro-Ethylène) plus connu sous son nom commercial, le Teflon, est utilisé principalement comme joint d'étanchéité grâce à ses propriétés barrières à l'eau.
Hormone végétale
C'est aussi une phytohormone (hormone végétale) aux effets multiples.
Histoire
L'éthylène a été découvert en tant qu'hormone végétale en 1901, on remarquait que les feuilles des plantes situées à proximité des lampadaires (à lampe à gaz) tombaient prématurément.
En 1910, on s'aperçoit qu'un fruit confiné murit plus vite qu'un fruit à l'air libre. On fait alors un premier rapprochement avec l'éthylène. En 1934 on découvre les voies métaboliques de l'éthylène.
Et en 1960, par chromatographie en phase gazeuse, on arrive à doser l'éthylène émis par les plantes.
Biosynthèse
L'éthylène a pour origine la méthionine.
Dans le cycle de Yang la méthionine est transformée en S-adénosyl méthionine (SAM) par la SAM Synthétase :
Méthionine + ATP → SAM + PPi + P (SAM Synthétase)
La SAM est ensuite dégradée en 5'méthylthioadénosine (qui est réutilisé par le cycle de Yang) et en Acide 1-AminoCyclopropane-1-Carboxilique par l' ACC Synthase. Une partie de l'ACC est ensuite convertie en éthylène (volatile) grâce à l'ACC Oxydase, le reste va se conjuger avec du N-Malonyl pour donner du N-Malonyl ACC (non volatile) stocké en une réserve métabolique qui pourra être hydrolysée en fonction des besoins de la plante.
Facteurs inducteurs
Le facteur limitant est la production d'ACC (Acide 1-AminoCyclopropane-1-Carboxilique) par l'ACC Synthase. Cette hormone est présente en quantité très faible dans le cytosol, dans les fruits en maturation (au moment ou l'éthylène est le plus abondant), elle représente environ 0,0001%. Sa production est régulée par des facteurs environnementaux comme une blessure, le froid, un stress hydrique, une diminition de l'O2 (immersion dans l'eau); ainsi que par des facteurs endogènes : l'auxine ou les cytokinines, mais aussi l'éthylène. Pour cela, la production d'éthylène est un phénomène autocatalytique.
Inhibiteurs
L'AOA (acide aminooxyacétique) et l'AVG (Aminoéthoxyvinyglycine) bloquent le fonctionnement de l'ACC Synthase.
Une absence d'oxygène (anaérobie), des fortes températures (sup. à 35 °C), des ions cobalt Co2+, inhibent le fonctionnement de l'ACC Oxydase.
Le nitrate d'argent AgNO3-, le thiosulfate d'argent Ag(S2O3)2−3 ou un milieu enrichi en CO2, inhibent en aval l'action de l'éthylène.
Le cyclopropène de méthyle (1-MCP) se fixe de façon presque irréversible sur les récepteurs éthylène, qui transmettent alors un signal conduisant à l'inactivité du système de perception, malgré la présence de molécules d'éthylene sur des récepteurs proches.
Effets
L'éthylène module de nombreux métabolismes (réponses des plantes aux stress biotiques et abiotiques), est impliquée dans les étapes de floraison et stimule la maturation de nombreux fruits. Cette molécule a des effets si variés parce qu'elle est très simple et donc peu spécifique.
Maturation des fruits
L'éthylène est un catalyseur essentiel de la maturation des fruits. Par exemple, un avocat ne mûrit pas sur l'arbre mais six à huit jours après la récolte. On observe alors un pic de production d'ACC, puis d'éthylène qui déclenche la maturation du fruit. Un fruit dont la maturation est dépendante de l'éthylène est classé comme "fruit climactérique".
La banane produit de l'éthylène pour mûrir, pour empêcher le murissement le froid ne suffit pas il faut aussi ventiler pour éviter l'accumulation d'éthylène . Quand on veut redémarrer le murissement il suffit de diffuser de l'éthylène.
Sénescence des organes
La sénescence des organes est un processus génétiquement programmé influençant l'âge physiologique des entités vivantes. Un apport exogène d'ACC ou d'éthylène entraîne une sénescence prématurée, alors qu'un apport exogène de cytokinine retarde le processus.
Un augmentation de la production d'éthylène est associée à une perte de chlorophylle des feuilles, une dégradation des protéines et des ARN, une perte de pigmentation des fleurs, et autres symptômes de vieillissement.
Abscission des feuilles
(= chute des feuilles - ou d'autres parties de la plante)
/!\ Ne pas confondre avec l'acide abscissique.
Les cellules des zones nécessitant une abscission répondent spécifiquement à l'éthylène. Une multitude d'enzymes hydrolytiques telles que des pectinases ou des polygalacturonases (qui dégradent l'acide galacturonique) sont alors stimulées, lysent les parois cellulaires et fragilisent la structure du végétal. Le plus souvent un agent extérieur tel que le vent, donne le coup de grâce et fait tomber l'organe.
Les jeunes feuilles produisent de l'auxine qui les insensibilise à l'éthylène. Après le développement de la feuille, la production d'auxine diminue puis s'arrète : les cellules du pétiole sont alors exposées à des concentrations de plus en plus fortes d'éthylène. Au bout d'un certain temps les zones d'abscission répondent par la synthèse d'enzymes hydrolytiques.
De très fortes concentrations d'auxine stimulent la production d'éthylène et donc la chute des feuilles.
Mouvements d'épinastie
Les racines percoivent l'inondation par une forte diminution de la concentraion en dioxygène dans le milieu. L'anoxie stimule la production de SAM (SAM Synthétase) et entraîne une augmentation de la teneur en ACC car l'ACC Oxydase ne fonctionne pas : elle ne peut pas oxyder sans oxygène ! L'ACC exédentaire des racines finit par se retrouver dans les feuilles pour être transformé en éthylène. C'est cet éthylène qui est responsable des mouvements d'épinastie.
La floraison
Cette hormone inhibe la floraison sauf chez certaines espèces comme la mangue ou l'ananas ou on synchronise la floraison des fruits en apportant de l'éthylène sur l'arbre.
L'éthylène peut changer la nature des organes floraux. Chez les espèces monoïques, c'est une hormone féminisante.
Voir aussi
Références
- ↑ a , b , c , d , e , f , g et h ETHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Éthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
- Portail de la botanique
Catégories : Produit chimique extrêmement inflammable | Réfrigérant | Alcène | Hormone végétale | Monomère
Wikimedia Foundation. 2010.