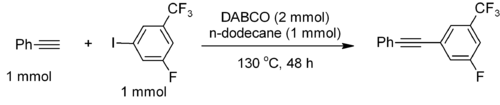- 1,4-diazabicyclo(2.2.2)octane
-
1,4-diazabicyclo[2.2.2]octane 
Général Nom IUPAC 1,4-diazabicyclo[2.2.2]octane Synonymes DABCO
triéthylènediamine
TEDA
1,4-éthylènepipérazineNo CAS No EINECS No RTECS PubChem SMILES InChI Apparence poudre blanche cristalline Propriétés chimiques Formule brute C6H12N2 [Isomères] Masse molaire[2] 112,1729 ± 0,006 g·mol-1
C 64,24 %, H 10,78 %, N 24,97 %,pKa pKa1=8,82[1] Propriétés physiques T° fusion 156-159 °C[3],[4],[1] T° ébullition 174 °C[1] Solubilité 450 g·l-1 dans l'eau à 25 °C[1] Masse volumique 1,02 g·cm-3 à 25 °C[3] Point d’éclair 62 °C[3] Limites d’explosivité dans l’air 2,9 mmHg à 50 °C[3] Propriétés optiques Indice de réfraction  = 1,4634[3]
= 1,4634[3]Précautions Directive 67/548/EEC[3],[5] 
Xn
F
NPhrases R : 11, 22, 36/37/38, 52/53, Phrases S : 26, 60, Transport[6] 40 1325 Écotoxicologie DL50 1 700 mg·kg-1 (rat, oral)[1]
2 250 mg·kg-1 (cochon d'Inde, oral)[1]
1 100 mg·kg-1 (lapin, oral)[1]Unités du SI & CNTP, sauf indication contraire. DABCO ou le 1,4-diazabicyclo[2.2.2]octane est une diamine bicyclique saturée. Il est utilisé comme catalyseur, particulièrement dans la synthèse de polyuréthanes, et comme ligand. DABCO est un catalyseur utile dans la réaction de Baylis-Hillman (en). Tandis que la plupart des animes de bas poids moléculaire ont une odeur forte et désagréable, le DABCO sent comme les cacahuètes grillées[7][réf. nécessaire]
Le DABCO est également utilisé pour ajuster le pH de la Résine (constituant) sensible à l'oxygène (pour en réguler la vitesse de réaction) utilisée dans les DVD limités dans le temps Flexplay (en). Les antioxydants, comme DABCO, sont utilisés pour améliorer la durée de vie de colorants. Cela rend le DABCO utile dans les lasers à colorants et pour le montage des échantillons de microscopie à fluorescence (lorsqu'il est utilisé avec le glycérol et PBS)[8].Le DABCO peut également être utilisé pour déméthyler des sels d'ammonium quaternaire par chauffage dans le N,N-diméthylformamide (DMF)[9].
DABCO est aussi utilisé comme catalyseur dans le couplage de Sonogashira sans métal et sans activation micro-onde[10]. Par exemple, le phényléthyne se couple avec les iodoarènes électroniquement déficitaires pour former le produit de Sonogashira avec un rendement de 77% et une sélectivité de 95% :
Dabco® est un nom de marque enregistré pour une ligne de catalyseurs aminés d'Air Products and Chemicals et contenant du 1,4-diazabicyclo[2.2.2]octane.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « DABCO » (voir la liste des auteurs)
- 1,4-Diazabicyclo(2.2.2)octane sur ChemIDPlus.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- 1,4-Diazabicyclo[2.2.2]octane chez Sigma-Aldrich.
- NIST : Triethylenediamine.
- Safety data for 1,4-diazabicyclo(2.2.2)octane de l'Université d'Oxford
- Entrée de « 1,4-Diazabicyclo(2.2.2)octane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 octobre 2010 (JavaScript nécessaire)
- note : cette phrase issue de la traduction de l'article anglais dit que DABCO sent comme les cacahuètes en insistant sur le fait que DABCO, contrairement aux petites amines, ne pue pas! tandis que la fiche GESTIS écrit : "Odour: ammonia like".
- Valnes K, Brandtzaeg P, « Retardation of immunofluorescence fading during microscopy », dans J. Histochem. Cytochem., vol. 33, no 8, août 1985, p. 755–61 [texte intégral, lien PMID]
- Ho, T.L, « Dealkylation of Quaternary Ammonium Salts with 1,4-Diazabicyclo[2.2.2]octane », dans Synthesis, vol. 1972, 1972, p. 702 [lien DOI]
- Rafael Luque, « Efficient solvent- and metal-free Sonogashira protocol catalysed by 1,4-diazabicyclo(2.2.2) octane (DABCO) », dans Organic and Biomolecular Chemistry, Royal Society of Chemistry, vol. 7, no 8, 2009, p. 1627 – 1632 [lien PMID, lien DOI]
Voir aussi
Catégories :- Produit chimique nocif
- Produit chimique facilement inflammable
- Produit chimique dangereux pour l'environnement
- Amine
- Composé hétérocyclique comportant de l'azote
- Composé hétérocyclique à 2 cycles
- Réactif pour la chimie organique
Wikimedia Foundation. 2010.