- Tétraèdrane
-
Tétraèdrane
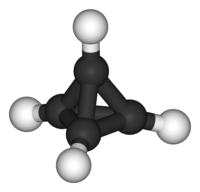
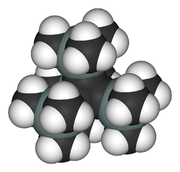
Le tétraèdrane est l'hydrocarbure de Platon de formule C4H4 et de forme tétraédrique. Son nom IUPAC est tricyclo[1.1.0.02,4]butane. Les angles entre les liaisons carbone-carbone dans le tétraèdrane (60°) sont considérablement plus petits que de l'angle idéal de liaison (109.5°) pour une hybridation sp3 des orbitales atomiques du carbone. Il en résulte une contrainte angulaire extrême qui explique que le tétraèdrane sans substituant n'ait pas encore été synthétisé et qu'aucun dérivé du tétraèdrane n'existe naturellement.En 1978, Günther Maier a préparé le premier tétraèdrane substitué stable, le tétra-tert-butyl tétraèdrane[1]. Ces substituants ter-butyl sont très encombrants et enveloppent complètement le cœur tétraédrique. Les liaisons dans ce cœur ne peuvent se briser en raison des forces de Van der Waals qui maintiennent les substituants très proches entre eux (effet corset).
Sommaire
Tétra(triméthylsilyl) tétraèdrane
Dans le tétra(triméthylsilyl)tétraèdrane (I)[2], les groupes ter-butyl ont été remplacés par des groupes triméthylsilyl(en). Ce composé est remarquablement plus stable que l'analogue tert-butyl. Pourtant, la liaison silicium-carbone (187 picomètre, 1,87 Angstrom)[3] est sensiblement plus longue qu'une liaison carbone-carbone (154 pm, 1,54 Å)[4] et donc l'effet corset est réduit. D'un autre coté, le groupe triméthylsilyl est un sigma donneur ce qui explique la plus grande stabilité de ce tétraèdrane. Alors que le dérivé tert-butyl fond à 135°C, température à laquelle sa décomposition en cyclobutadiène commence, le triméthyl silyl tétraèdrane fond à la température bien plus haute de 202°C et est stable jusqu'à 300°C, température à laquelle il se convertit dans le dérivé acétylènique qui a servi au début de sa synthèse.
Les liaisons du squelette du tétraèdrane sont coudées (liaisons bananes(en)), l'hybridation des orbitales des carbones a un caractère sigma marqué. Du spectre RMN peut être déduite une hybridation sp des orbitales du carbone ce qui correspond normalement à des triples liaisons. En conséquence, la longueur de 152pm (1,52 Å) des simples liaisons carbone-carbone est inhabituellement courte.
Le dernier développement est la synthèse et la caractérisation du dimère tétraèdranyl-tétraèdrane (II). La liaison de connexion entre les deux tétraèdranes est encore plus courte, 143,6 pm (1,436 Å)! -une liaison simple carbone-carbone ordinaire mesure 154 pm (1,54 Å)-.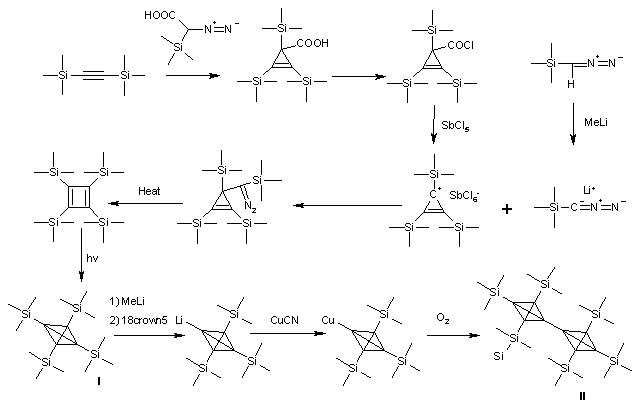
Tétrasila-tétraèdrane
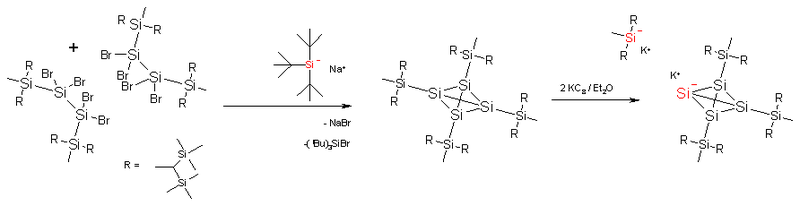
Dans le tétrasila-tétraèdrane, les atomes de carbone sont remplacés par du silicium. La longueur standard des liaisons Si-Si est plus grande (235 pm). Seuls les dérivés substitués par des silyl très larges ont le cœur tétraédrique suffisamment enveloppé, pour être thermiquement stables.
Le tétra-(R-silyl)-tétrasila-tétraèdrane, figuré ci-dessous, peut être réduit par le potassium-graphite pour former le sel tri-(R-silyl)-tétrasila-tétraèdranure de potassium. Dans ce composé, un des atomes de silicium du cœur a perdu son substituant R-silyl et porte une charge négative. Le cation potassium peut être capturé par un éther couronne et alors le complexe de potassium et l'anion silyl se retrouvent séparés par une distance de 885 pm. Une des deux liaisons Si- - Si mesure 272 pm et le Si- garde un symétrie tétraédrique car le doublet électronique qu'il porte, pointe vers l'extérieur du tétrasila-tétraèdrane. Cependant les quatre atomes de silicium du cœur sont équivalents à l'échelle de temps de la spectroscopie RMN (Résonance Magnétique Nucléaire), ce qui est dû à la migration ultra-rapide des substituants R-silyl autour du cœur.[5]La réaction de dimérisation observée pour le tétratriméthylsilyl tétraèdrane était aussi attendue pour un tétrasila-tétraèdrane[6].
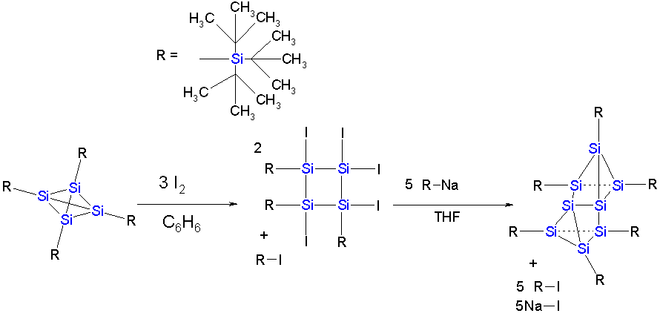
Dans le tétrasila-tétraèdrane figuré ci-dessous, le cœur est encagé par 4 groupes super silyl(en) dans lesquels chaque atome de silicium a trois substituants ter-butyl. Mais le dimère ne peut être synthétisé. En revanche, une réaction avec de l'iode dans le benzène suivie par une réaction de l'anion tri-ter-butyl sila-, forme un cluster à huit atomes de silicium qui peut être décrit comme un axe Si2 (long de 229 pm et avec, pour les Si, une géométrie telle que les 4 liaisons soient orientées d'un même coté de l'espace) pris en sandwich entre deux cycles Si3 quasiment parallèles.Il est connu que dans les clusters à huit atomes des éléments du même groupe chimique que le silicium, Sn8R6 pour l'étain et Ge8R6 pour le germanium, ces huit atomes sont localisés aux sommets d'un cube.
Perspectives
Le tétraèdrane non substitué nous échappe pour l'instant mais il est prédit être cinétiquement stable. Une stratégie qui a été explorée mais est vaine pour l'instant est la réaction du propène avec du carbone atomique[7]. Encapsuler un tétraèdrane dans un fullerène a seulement été essayé in silico[8].
Notes
Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Tetrahedrane ».
- ↑ (en) Tetra-tert-butyltetrahedrane, G. Maier, S. Pfriem, U. Schäfer and R. Matusch; 1978; Angewandte Chemie International Edition in English, 17 (7), pp 520–521. DOI:10.1002/anie.197805201
- ↑ Hexakis(trimethylsilyl)tetrahedranyltetrahedrane, M. Tanaka and A. Sekiguchi; 2005; Angewandte Chemie International, 44 (36), pp 5821–5823. DOI:10.1002/anie.200501605
- ↑ http://www.geocities.com/Tokyo/3238/mendelei.html
- ↑ en:Bond_length
- ↑ Tetrasilatetrahedranide: A Silicon Cage Anion, Masaaki Ichinohe, Masafumi Toyoshima, Rei Kinjo, and Akira Sekiguchi; 2003; J. Am. Chem. Soc., 125 (44), pp 13328–13329. DOI:10.1021/ja0305050
- ↑ , Si8(Si-tert-Bu3)6: A Hitherto Unknown Cluster Structure in Silicon Chemistry, G. Fischer, V. Huch, P. Mayer, S. K. Vasisht, M. Veith and N. Wiberg; 2005; Angewandte Chemie International Edition, 44 (48), pp 7884–7887. DOI:10.1002/anie.200501289
- ↑ Tetrahedrane—Dossier of an Unknown,Adelina Nemirowski, Hans Peter Reisenauer, and Peter R. Schreiner; Chem. Eur. J.; 2006, 12, pp 7411 – 7420. DOI:10.1002/chem.200600451
- ↑ Endohedral complex of fullerene C60 with tetrahedrane, C4H4@C60, Xiao-Yuan Ren a, Cai-Ying Jiang a, Jiang Wanga, Zi-Yang Liu; Journal of Molecular Graphics and Modelling; 2008, 27, pp 558–562. DOI:10.1016/j.jmgm.2008.09.010
- Portail de la chimie
Catégories : Cyclopropane | Hydrocarbure de Platon
Wikimedia Foundation. 2010.