- Solvate
-
Solvatation
La solvatation est le phénomène physico-chimique observé lors de la dissolution d'un composé chimique dans un solvant.
Lors de l'introduction d'une espèce chimique initialement à l'état solide (sous forme de cristal ou bien amorphe) dans un solvant, les atomes, ions ou molécules du solide sont liés entre eux. Le produit ne va se dissoudre que si les molécules du solvant réussissent à rompre les liaisons dans le solide :
- soit par réaction chimique ;
- soit en affaiblissant suffisamment les liaisons (par exemple, l'eau divise les forces électrostatiques par environ 80).
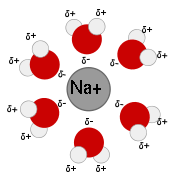
La solvatation est cette action des molécules du solvant sur le solide.
Pour qu'il y ait dissolution, les molécules du solvant doivent donc avoir une affinité avec les constituants du solide. Donc, les espèces dissoutes sont entourées par des molécules de solvant.
Cette action des molécules de solvant sur le solide constitue la solvatation.
La solvatation d'une espèce dépend de la nature du solvant et du soluté. En règle générale, un composé polaire sera très bien solvaté dans un solvant polaire, tandis qu'un composé apolaire sera mieux solvaté dans un solvant apolaire.
La solvatation dans l'eau est aussi appelée hydratation.
Sommaire
Thermochimie
Si les molécules de solvant entourent le soluté, c'est que cette configuration est plus stable. On appelle solvate cette combinaison chimique d'un corps dissous avec le solvant. En terme thermochimique, on définit une énergie de solvatation.
Il y a dissolution si l'énergie de solvatation est supérieure à l'énergie de liaison des espèces solutées entre elles (par exemple, attraction coulombienne pour un cristal ionique).
Répartition dans la solution
Si une molécule ou un ion de soluté se retrouve à la surface du liquide, il ne disposera pas de la totalité de son « bouclier » de molécules de solvant. D'un point de vue thermochimique, son énergie sera plus élevée.
Par conséquent, l'extrême surface de la solution — les premières couches moléculaires — est constituée de solvant quasiment pur. [1]
Mobilité des espèces
Une espèce solvatée est entourée par un « bouclier » de molécules de solvant. L'espèce solvatée est donc plus grosse que l'espèce seule. Sa mobilité est donc plus faible.
Voir aussi
- Portail de la chimie
Catégorie : Thermochimie
Wikimedia Foundation. 2010.