- Lien H
-
Liaison hydrogène
La liaison hydrogène ou pont hydrogène est une liaison physique non covalente, de type dipôle-dipôle. Elle est de basse intensité (vingt fois plus faible que liaison covalente classique), et relie des molécules en impliquant un atome d'hydrogène. On pensait à l'origine que le proton de cet atome était partagé entre les molécules liées[1], et donc que cette liaison hydrogène était quasi-covalente. On sait aujourd'hui qu'elle est à 90% électrostatique[2]. Bien que de la même famille que les forces de van der Waals, les liaisons hydrogène s'en distinguent par leur intensité : leur énergie de liaison est environ dix fois supérieure à celle de la force de van der Waals.
Pour que cette liaison s'établisse, il faut être en présence d'un donneur de liaison hydrogène et d'un accepteur :
- le donneur est composé d'un composé à H acide, c'est-à-dire un hétéroatome (azote, oxygène, fluor) porteur d'un atome hydrogène (comme dans les amines, alcools, thiols) ;
- l'accepteur est composé d'un hétéroatome (uniquement azote, oxygène ou fluor) porteur de doublets libres.
Lorsqu'une liaison hydrogène s'établit, les deux hétéroatomes se trouvent à une distance d'environ 2 Å, c'est-à-dire 0,2 nm.
Exemples : H2O ... H−O−H ; −C=O ... H−O−H
Sommaire
Conséquences de la liaison hydrogène
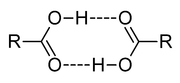
- La liaison hydrogène s'établit alors entre toutes les molécules présentant les caractéristiques précédemment évoquées ; voyons par exemple le cas d'un acide carboxylique (R-COOH).
On remarque que toutes les molécules sont liées entre elles au niveau de la fonction alcool. Le radical alkyl "R" aura alors une influence non-négligeable sur la force de cette liaison. En effet, la longueur de la chaine et sa composition vont polariser de façon plus ou moins marquée la liaison entre l'hydrogène et le carbone. Si la liaison H (comme on l'appelle plus couramment) est affaiblie, la cohésion inter-moléculaire le sera également et la température d'ébullition de la substance en question sera plus faible. Autrement dit, il faudra moins d'énergie (par le biais de la chaleur) pour séparer les molécules les unes des autres. Au contraire, pour l'eau (H2O), l'ammoniaque (NH3), ou le fluorure d'hydrogène (HF), la liaison X-H est tellement polarisée que les liaisons H qui s'établissent confèrent aux substances des points d'ébullition anormalement hauts.
- Une autre illustration peut être celle de l'eau solide (glace). En effet, la molécule d'eau est l'exemple typique de la liaison H. Les liaisons H s'établissent, de sorte que l'état liquide de l'eau est l'état le plus compact, tandis que pour tout autre corps pur c'est l'état solide. Dans la glace, l'eau est en structure tétraèdrique (structure rendue possible par ces liaisons), et la compression d'un bloc de glace conduit au retour à l'état liquide. C'est pourquoi la glace occupe plus de volume que l'eau, en quantités égales (le glaçon flotte sur l'eau).
- Enfin - et bien que la liste ne puisse être exhaustive tant le domaine d'application de cette liaison est vaste - on mentionnera le cas des polymères, tel le Poly-para-phénylène téréphtalamide (plus connu sous le nom de Kevlar). Les chaines de polymères s'attachent entre elles par des liaisons H lui conférant ainsi ses propriétés si intéressantes de résistance. Pour en savoir plus : Kevlar.
Les liaisons hydrogène par type
Nous distinguons en général trois types de liaisons hydrogène :
1. Faibles avec des enthalpies de liaison entre 1 et 4 kJ·mol−1 ;
- Les liaisons hydrogène de cette intensité sont semblable aux forces de van der Waals. Ils sont de catégorie électrostatique. Dans une interaction de ce type, la distance entre les atomes se situe entre 2.2 et 4.0 Å et l’angle que forme ces liens se situe entre 90º et 150º.
- Les meilleurs exemples de ponts hydrogène faibles sont les dimères en phase gazeuse contenant certains acides faibles et les systèmes dans lesquels on retrouve des liens C—H˖˖˖O/N et O/N—H˖˖˖π. Par contre, il est important de noter qu’en phase gazeuse, ces liaisons n’ont lieu que si le gaz est réel et non parfait.
2. Modérées avec des enthalpies entre 4 et 15 kJ·mol−1 ;
- Étant donné que ce type de liaisons se situe entre les deux extrêmes, leurs propriétés ont des valeurs médianes: une longueur de liens située entre 1.5 et 3.2 Å et des angles de 130º à 180º.
- Tous les acides carboxyliques, les alcools, les phénols, les «hydrates» et molécules biologiques comprennent des liaisons hydrogènes modérées.
3. Fortes avec des enthalpies entre 15 et 40 kJ·mol−1.
- Semblables aux liens covalents, les ponts hydrogène forts constituent des interactions plus rapprochées, soit de 1.2 à 2.5 Å. Les angles que forment ces liens sont de 175º -180º donc plus grands que ceux des liaisons faibles.
- Les «dimères» en phase gazeuse contenant des acides forts, des sels acides, des «éponges à protons», des «pseudohydrates» et des complexes HF en sont de bons exemples.
Un exemple de liaison très forte est FH–F−1 dans KHF2 avec environ 212 kJ·mol−1. On peut penser que dans ce cas il vaut mieux écrire F–H–F. La distance totale entre F–H–F est de 2,49 Å seulement et il se forme un angle de 120 ° entre les différentes molécules.
Propriétés des ponts hydrogènes
Trois grandes caractéristiques définissent les liaisons hydrogènes ainsi que leur interactivité :
1. Les liaisons hydrogènes sont des liens intermoléculaires dont les atomes qui la compose, respectent une certaine directionalité. Dans un réseau de ponts H, leur architecture est donc très optimisée. Cette propriété des ponts H permet à l’eau de cristalliser de façon définie pour se changer en glace. Les conditions de refroidissement affectent la géométrie du réseau cristallin de la glace. Ces interactions sont aussi responsables d’une propriété de l’eau: la densité de celle-ci à l’état liquide qui, à 4°C, est supérieure à celle de la glace. En conséquence, la glace tend à flotter sur l’eau liquide.
2. Due à leur intensité plus faible, les liaisons hydrogènes peuvent se modifier à température ambiante, contrairement aux liaisons covalentes. En effet, à environ 27°C, les ponts H peuvent évoluer en se modifiant par bris ou formation de nouvelles interactions. C’est de cette flexibilité qu’ont besoin, entre autres, les molécules biologiques afin d’être en constante évolution. Cette propriété est également indispensable à la solubilisation des espèces hydrophiles dans l’eau. Plusieurs molécules d’eau contiennent suffisamment de liaisons hydrogènes souples à température pièce, pour former une « cage » flexible de solvatation autour des ions afin de les empêcher de former d’autres liens avec différents ions de charge opposée.
3. Les structures secondaires des protéines, comme l’hélice alpha et le feuillet beta, sont formées grâce à un agencement spécifique de ponts H. Ces structures secondaires sont reliées les unes aux autres par des boucles de forme non définie pour former une structure tertiaire. Les hélices de l’ADN sont également maintenues par de liaisons hydrogènes. On peut donc supposer que les liaisons hydrogènes dans l’eau et dans les protéines auraient joué des rôles cruciaux dans le développement de la vie sur Terre et même de son apparition.
Notes
http://www.cnrs.fr/cw/dossiers/doseau/decouv/proprie/liaisonHydro.html | titre = La liaison hydrogène | auteur = Yves Maréchal | consulté le = 25 avril 2009
A. Jeffrey, G., An introduction to hydrogen bonding, Series Editor, 1997, 11 à 14 p.Article connexe
- Portail de la chimie
- Portail de la biochimie
Catégories : Liaison chimique | Réaction chimique | Hydrogène
Wikimedia Foundation. 2010.