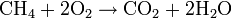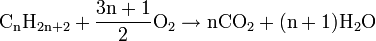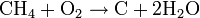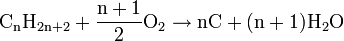- Hydrocarbure saturé
-
Alcane
Les alcanes sont des hydrocarbures saturés. C’est-à-dire qu'ils ne sont constitués que d'atomes de carbone (C) et d'hydrogène (H). Les alcanes se différencient des hydrocarbures insaturés (les alcènes, les alcynes, et les composés aromatiques) par le fait que les atomes ne sont liés que par des liaisons simples, ce qui donne un nombre maximal d'atomes d'hydrogène (d'où le nom de "saturé"). Les alcanes non cycliques possèdent donc une formule brute de la forme CnH2n+2 où n est un entier naturel.
Sommaire
Nomenclature
Les premiers sont :
À partir du butane (n=4), il existe plus d'une formule développée. On parle alors d'isomères pour désigner les molécules ayant la même formule brute mais des formules développées différentes. Tous cela donne une grande possibilité de créations et les conventions de nommages en découlent. La nomenclature des alcanes est donc extrêmement logique .Réactions chimiques des alcanes
Les alcanes existent en grande quantité sous forme de gisements naturels de gaz ou de pétrole. L'origine de ces gisements est attribuée à la fermentation de la cellulose des végétaux des temps préhistoriques.
Le gaz naturel est essentiellement constitué de méthane et les pétroles contiennent un mélange d'hydrocarbures (dont des alcanes allant de CH4 à C40H82).
Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante.
À partir de C5, on rencontre des liquides et à partir de C17 des solides.
Les alcanes liquides ou solides ont une densité assez faible (environ 0,7). Comme tous les hydrocarbures, ils sont insolubles dans l'eau ; par contre, ils sont miscibles avec la plupart des liquides organiques et sont eux-mêmes des solvants pour de nombreux composés organiques.
D'une façon générale, les alcanes sont assez peu réactifs, autrement dit stables. Ceci s'explique par le fait que les liaisons C-C et C-H sont assez fortes :
- C-C = 82,6 kcal/mol
- C-H = 100 kcal/mol
- (1 cal = 4,18 J)
Les alcanes peuvent réagir dans plusieurs réactions :
- Réaction de combustion : on brise la liaison C-C (le squelette de la molécule). Il en existe deux types (Exemple avec du méthane):
- la complète qui produit du dioxyde de carbone et de l'eau
- l'incomplète qui produit du carbone (solide) et de l'eau
- Réaction de substitution : on brise la liaison C-H (on substitue H par un autre élément) Exemple: chloration du méthane
-
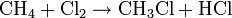 (formation de monochlorométhane et de chlorure d'hydrogène gazeux)
(formation de monochlorométhane et de chlorure d'hydrogène gazeux)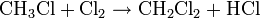 (formation de dichlorométhane et de chlorure d'hydrogène gazeux)
(formation de dichlorométhane et de chlorure d'hydrogène gazeux)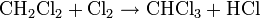 (formation de trichlorométhane (chloroforme) et de chlorure d'hydrogène gazeux)
(formation de trichlorométhane (chloroforme) et de chlorure d'hydrogène gazeux)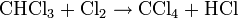 (formation de tetrachlorométhane et de chlorure d'hydrogène gazeux)
(formation de tetrachlorométhane et de chlorure d'hydrogène gazeux)
- Réaction de déshydrogénisation: on créé une double liaison entre 2 carbones ( C=C ) de la chaînes en brisant la liaison de 2 H. Le produit resultant est un alcène.
La réaction de combustion des alcanes n'a pas un grand intérêt au niveau chimique car la molécule est complètement détruite. Par contre cette combustion a un grand intérêt pratique puisque les alcanes peuvent être utilisés comme carburant ou combustible du fait que cette réaction est très exothermique (elle libère de la chaleur).
Formule développée de l'éthane:
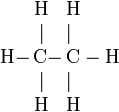
En formule semi-développée : CH3 − CH3
Les différents alcanes
Les alcanes linéaires
Ce sont les alcanes abordés précédemment de formule CnH(2n + 2)
Les alcanes ramifiés
Définition
Ce sont des alcanes linéaires auxquels on a remplacé un H par un groupement alkyle (par exemple ; le méthyle : -CH3, ou l'éthyle : -CH2-CH3)
Nomenclature
Prenons l'exemple de cette molécule :
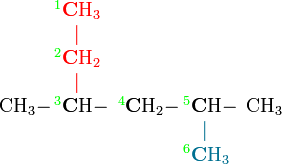
Au départ, il s’agissait d'une molécule de pentane à laquelle on a ajouté un groupement éthyle (en rouge) et un groupement méthyle (en bleu).
Pour nommer cette nouvelle molécule, il faut :
- Commencer par trouver puis numéroter la plus longue chaîne de carbone (ici, les carbones de cette chaîne sont en gras)
- Numéroter ses carbones (ici, les carbones sont numérotés en vert)
- Ensuite on regarde quels sont les groupements attachés à cette chaîne carbonée et à quel carbone ils sont rattachés :
- Un groupement méthyle -CH3 sur le carbone n° 3
- Un autre groupement méthyl -CH3 sur le carbone n° 5
- On nomme la chaîne carbonée comme un alcane (ici il y a six carbones donc hexane)
- On assemble le tout, le nom de la molécule serait : 3,5-diméthylhexane (une virgule sépare les chiffres entre eux, un tiret sépare les chiffres des noms)
On peut numéroter la chaîne dans l'autre sens
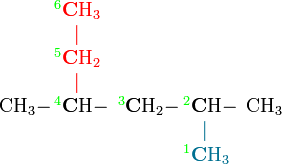
- et dans ce cas, les deux groupements méthyle se retrouvent sur les carbones 2 et 4, le nom de la molécule serait donc : 2,4-diméthylhexane
Pour choisir entre les deux noms, on regarde les indices, et on choisit celui dont le premier indice est le plus petit. (Donc ici, le 2,4-diméthylhexane)
Remarques
Toujours sur l'exemple du 2,4-diméthylhexane :
- Pour indiquer qu'il y a deux groupements méthyle, on peut mettre diméthyl
- Dans les noms de molécules, on enlève le e de méthyle, éthyle, etc.
- Si deux groupements méthyle avaient été sur le carbone 2 (et aucun ailleurs), on aurait dû mettre 2,2 -diméthylhexane
S'il y avait eu un groupement éthyle sur le carbone 3 et un méthyle sur le carbone 2, le nom aurait été 3-éthyl-2-méthylhexane (on place l'éthyl avant le méthyl car on classe les groupements alkyle par ordre alphabétique). Pour choisir entre les deux noms, on regarde les indices, et on choisit celui dont la somme des indices est la plus petite.
Liste des alcanes ramifiés
Les listes des alcanes peuvent être obtenues via leur formule brute:
Les alcanes cycliques
voir Cycloalcane
Définition
Ce sont des alcanes sur lesquels les carbones sont liés par des liaisons simples de manière à former un cycle qui n'est pas plan. Ils ont pour formule CnH2n.
Représentation
Cyclohexane CH2 - CH2 / \ CH2 CH2 \ / CH2 - CH2Nomenclature
- Pour nommer un cycloalcane, il suffit de rajouter le préfixe cyclo- au nom de l'alcane linéaire ayant le même n, sachant qu'il ne peut y avoir de cycle qu'avec n > 2
Exemples :
cyclopropane cyclobutane cyclopentane cyclohexane cycloheptane cyclooctane cyclononane cyclodécane C3H6 C4H8 C5H10 C6H12 C7H14 C8H16 C9H18 C10H20 Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
Catégories : Alcane | Groupe fonctionnel
Wikimedia Foundation. 2010.