- 100-42-5
-
Styrène
Styrène 
Général Synonymes Phényléthylène
Vinyl benzène
Cinnamène
StyrolNo CAS No EINECS FEMA SMILES InChI Apparence liquide huileux, incolore à jaune.[1] Propriétés chimiques Formule brute C8H8 [Isomères] Masse molaire 104,1491 g∙mol-1
C 92,26 %, H 7,74 %,Propriétés physiques T° fusion -30,6 °C[1] T° ébullition 145 °C[1] Solubilité dans l'eau à 25 °C : 0.03 g/100 ml[1] Masse volumique (eau = 1) : 0.9[1] T° d’auto-inflammation 490 °C[1] Point d’éclair 31 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 0.9-6.8[1] Pression de vapeur saturante à 20 °C : 0.7 kPa[1] Propriétés optiques Indice de réfraction 1,546 Précautions Directive 67/548/EEC 
XnPhrases R : 10, 20, 36/38, Phrases S : (2), 23, Transport 39 2055 NFPA 704 SIMDUT[3] 

SGH[4] 

AttentionClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[2] Inhalation vertige, somnolence, nausée, faiblesse Peau rougeur Yeux rougeur, douleur Écotoxicologie LogP 3.2[1] DJA 0,12 mg/kg p.c./jour[5] Unités du SI & CNTP, sauf indication contraire. Le styrène est un composé organique aromatique de formule chimique C8H8. C'est un liquide à température et à pression ambiantes. Il est utilisé pour fabriquer des plastiques, en particulier le polystyrène. Le styrène est un composé chimique incolore, huileux, toxique et inflammable. Il est naturellement présent en faibles quantités dans certaines plantes, et est produit industriellement à partir du pétrole. De faibles concentrations de styrène sont également présentes dans les fruits, les légumes et la viande.
Sommaire
Histoire
Autour de 1835, le pharmacien berlinois Eduard Simon acquiert du styrax, une résine également appelée « ambre liquide » issue du Liquidambar orientalis, un arbre poussant au Proche-Orient. Cette résine a subi des traitements et a été mélangée, notamment à du parfum. En distillant cette résine, Simon obtient un liquide incolore qu'il baptise styrène en référence au nom de la résine. En chauffant ce liquide, il obtient une nouvelle substance, qu'il suppose être de l'oxyde de styrène. Cependant, les chimistes britanniques John Blyth et August Wilhelm von Hofmann découvrent en 1845 par analyse élémentaire que la composition de la matière n'a pas changé au cours de la transformation. Il faut attendre 1866 pour que Marcellin Berthelot fournisse une interprétation correcte du phénomène : il s'agit d'une réaction de polymérisation. Hermann Staudinger, dont les travaux concernèrent principalement la chimie des polymères, écrit dans sa thèse que le chauffage du liquide entraîne une réaction en chaîne qui se traduit par l'apparition de macromolécules de polystyrène.
Le styrène est au centre d'un documentaire de 19 minutes réalisé en 1958 par Alain Resnais: Le chant du styrène. Le dialogue de Raymond Queneau qui est mis en valeur par la voix chaude et profonde de Pierre Dux, décrit ainsi cette réaction:
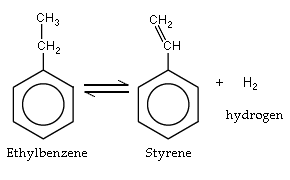
Le styrène est produit majoritairement par la déshydrogénation de l'éthyl-benzène surchauffé. La réaction nécessite un catalyseur tel que de l'oxyde de fer. Le styrène autrefois s'extrayait du benjoin, provenant du styrax, arbuste indonésien.
Propriétés physico-chimiques
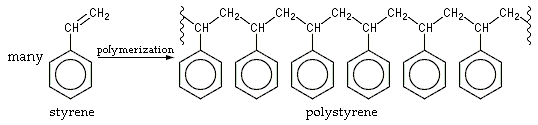
Le styrène possède une odeur agréable, détectable entre 0,43 mg/m3 et 866 mg/m3. Il est peu soluble dans l'eau, mais il possède une bonne solubilité dans l'acétone, l'éther, le disulfure de carbone et les alcools. Le styrène s'évapore facilement. La molécule de styrène possédant un groupement vinyle, et donc une double liaison carbone-carbone, elle peut polymériser. Le styrène liquide commence à polymériser à la température ambiante en formant un liquide jaune visqueux. Il peut être stabilisé par l'ajout de 50 ppm d'hydroquinone. Cependant, la stabilisation n'est possible qu'en présence de faibles quantités d'oxygène. La polymérisation est très nettement accélérée par la lumière. Le styrène doit donc être stocké au frais dans des récipients opaques.
Réactions chimiques
Le comportement chimique du styrène est similaire à celui du benzène, le styrène étant toutefois plus réactif. Il réagit principalement au cours de réactions de type substitution radicalaire, de substitution électrophile aromatique (par exemple la sulfonation ou la nitration) ainsi que d'addition radicalaire. Les réactions de type substitution nucléophile sont nettement moins fréquentes. Il s'oxyde en oxyde de styrène.
Le comportement du styrène vis-à-vis des réactions de polymérisation est assez inhabituel : il peut subir des polymérisations de type radicalaire, tout comme des polymérisations anioniques ou cationiques. Il peut ainsi copolymériser avec du chlorure de fer par polymérisation cationique. Le styrène seul polymérise par un mécanisme radicalaire pour former le polystyrène. Cette dernière réaction est initiée plus facilement en présence d'un catalyseur (plus exactement un initiateur dans le cas du polystyrène), de type peroxyde la plupart du temps.
Production
Avant 1930, date à laquelle des procédés de fabrication du styrène commencent à être développés, il est obtenu par séparation lors du raffinage du pétrole.
Il existe principalement deux procédés de fabrication du styrène à l'échelle industrielle. Le premier est un procédé de type déshydrogénation catalytique. Le styrène est fabriqué par chauffage vers 600 à 650 °C d'éthylbenzène (EB) en présence d'un catalyseur, généralement de l'oxyde de magnesium ou de l'oxyde de zinc. La réaction chimique est réversible (c'est un équilibre chimique) et endothermique. Le rendement est augmenté en travaillant sous pression réduite.
- C6H5C2H5 ←→ C6H5C2H3 + H2
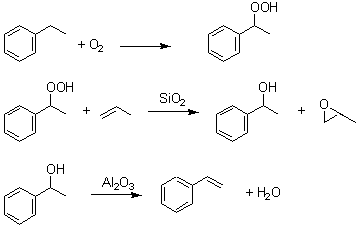
Le second procédé, moins utilisé, s'effectue en plusieurs étapes. L'éthylbenzène est d'abord oxydé à 150 °C sous une pression de 2 bar. Le produit formé (un peroxyde) réagit ensuite avec du propène à 115 °C sous pression élevée et en présence de silice pour former de l'α-phényléthanol. Ce dernier subit ensuite une déshydratation à 200 °C environ en présence d'alumine pour former le styrène.
En 1996, la production mondiale de styrène était d'environ 20 millions de tonnes.
Utilisation
Le styrène est utilisé comme monomère pour fabriquer des plastiques. Le plus important est le polystyrène (le styrène est le seul monomère).
De nombreux autres sont produits par copolymérisation (utilisation de plusieurs monomères), notamment l'acrylonitrile butadiène styrène ou ABS, le caoutchouc ou le latex à base de styrène butadiène ou SBS, ainsi que des polyesters insaturés. La production de styrène a notamment augmenté très rapidement aux USA durant la Seconde Guerre mondiale pour répondre aux besoins de caoutchouc synthétique pour l'armée. Le styrène est également utilisé en faibles quantités comme additif dans des parfums ou des médicaments. C'est également un solvant, utilisé notamment pour la synthèse de résines polyester.
Effets sur la santé
L'inhalation de concentrations élevées de styrène peut occasionner des troubles du système nerveux, tels que de la dépression ou des difficultés de concentration, de la faiblesse musculaire, des nausées ainsi qu'une irritation des yeux, du nez et de la gorge.
Des études sur des animaux ont révélé que la respiration de vapeurs de styrène pendant de courtes durées entraîne un endommagement des cloisons nasales. Une exposition plus longue occasionne des dégâts au foie. Aucune donnée n'est disponible concernant l'effet sur la santé humaine de la présence de faibles concentrations de styrène dans l'air respiré pendant de longues périodes.
Il n'y a également que peu de données sur les effets sur la santé humaine d'une exposition au styrène par ingestion ou contact avec la peau. Les études sur des animaux ont montré que l'ingestion de concentrations élevées de styrène sur plusieurs semaines occasionnent des dommages au foie, aux reins, au cerveau et aux poumons. Le contact direct sur la peau de lapins entraîne une irritation.
Les études sur des animaux ont également montré un effet négatif de l'exposition à de très hauts taux de styrène pendant de courtes périodes sur la reproduction et le développement du fœtus. Aucune donnée n'est disponible pour l'homme.
D'après l'Agence internationale de recherche sur le cancer, le styrène pourrait être cancérogène pour l'homme. Plusieurs études effectuées sur une population de salariés exposés au styrène ont mis en évidence un risque de leucémie. Des études sur des animaux ont montré que le styrène est faiblement cancérogène par inhalation ou ingestion.
Effets sur l'environnement
Sur l'échelle du MARPOL, le styrène a une toxicité B, c'est à dire qu'il est toxique mais peu persistant dans l'environnement. Il persiste dans un milieu marin pendant quelques jours, et est peu bioaccumulable. Par contre, en faible dose, le styrène peut induire une modification de couleur ou de goût des aliments marins.[6]
Phrases de risque et conseils de prudence
Étiquetage :
- R: 10 (Inflammable)
- R: 20 (Nocif par inhalation)
- R: 36/38 (Irritant pour les yeux et la peau)
- S: 2 (Conserver hors de la portée des enfants)
- S: 23 (Ne pas respirer les gaz/fumées/vapeurs/aérosols (terme(s) approprié(s) à indiquer par le fabricant))
Notes et références
Notes
- ↑ a , b , c , d , e , f , g , h , i et j STYRENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Styrène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- ↑ Propriétés du styrène
Références
- Styrol (Ethenylbenzol). Wiley/VCH, Weinh. (1990), ISBN 3-527-28255-6
- Frank-Dieter Kuchta:Thermische und laserinduzierte radikalische Polymerisationen von Styrol bis zu hohen Drücken, Temperaturen und Umsätzen. Cuvillier (1995), ISBN 3-89588-468-5
- Petra Schneider:Photoinitiierte Polymerisation von Styrol in festem Paraffin. Shaker Verlag (1996), ISBN 3-8265-1521-8
- Peter Quicker:Dehydrierung von Ethylbenzol zu Styrol : Ein Beitrag zur Entwicklung eines Membranreaktorverfahrens. Mensch & Buch, ISBN 3-89820-177-5
Voir aussi
Liens externes
- Portail de la chimie
Catégories : Produit chimique nocif | Hydrocarbure aromatique
Wikimedia Foundation. 2010.