- 75-19-4
-
Cyclopropane
Cyclopropane 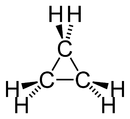
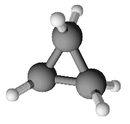
Formule développée et représentation 3D du cyclopropaneGénéral Nom IUPAC Cyclopropane No CAS No EINECS Apparence Gaz incolore,
odeur de l'éther de pétrolePropriétés chimiques Formule brute C3H6 [Isomères] Masse molaire 42,0797 g∙mol-1
C 85,63 %, H 14,37 %,Propriétés physiques T° fusion -127 °C T° ébullition 32,6 °C Solubilité 0,502 g/L dans l'eau Masse volumique 0,68 (liquide)
Densité du gaz :
1,4 (air=1)T° d’auto-inflammation 555 °C Précautions Directive 67/548/EEC 
F+Phrases R : 12, Phrases S : 2, 9, 16, 33, [1] NFPA 704 SGH[2] 

DangerUnités du SI & CNTP, sauf indication contraire. Le cyclopropane est un cycloalcane de formule brute C3H6 formé de trois atomes de carbone disposés de telle façon qu'ils forment une boucle, chaque atome de carbone étant aussi relié à deux atomes d'hydrogène. Les liaisons entre atomes de carbone y sont beaucoup plus faibles que les liaisons carbone-carbone habituelles. Ceci est dû à au fait que les atomes de carbone sont disposés en triangle équilatéral, formant des angles de 60°, soit près de deux fois moins de l'angle normal (109,5°). Le cyclopropane est donc beaucoup plus réactif que des alcanes acycliques ou que d'autres cycloalcanes tels que le cyclohexane ou le cyclopentane utilisé jadis comme anesthésique durant les guerres.
Sommaire
Utilisation
Le cyclopropane joue le rôle d'agent anesthésique lorsqu'il est inhalé. Cependant, il est de nos jours remplacé par d'autres anesthésiques, à cause de sa forte réactivité en conditions normales. En effet, mélangé à de l'oxygène, il y a un risque significatif d'explosion.
Généralisation
Le terme cyclopropane est également utilisé pour désigner toute une famille de molécules contenant le motif cyclique C3H6. La préparation de tels composés est souvent réalisée à partir de composés de type diazo. Ces derniers réagissent en solution pour libérer un intermédiaire carbène, qui réagit à son tour sur un alcène pour donner le cyclopropane. La réaction de Simmons-Smith est l'une des réactions adoptant ce mécanisme les plus utilisées. D'autres réactions, mettant en jeu des catalyseurs contenant du rhodium, du cuivre ou du zinc, permettent en outre de générer ce type de composés en influençant la stéréochimie du produit.
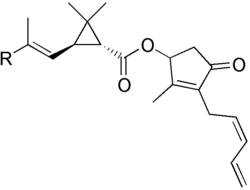
Certaines molécules contenant un motif cyclopropane sont aujourd'hui utilisées comme insecticides (notamment l'Acrinathrine, la Bifenthrine, la Pyréthrine, etc...).
Liens externes
- (fr) Fiche de sécurité Air Liquide sur le cyclopropane
- (fr) Fiche d'Air Liquide sur le cyclopropane
- (en) La réaction de Simmons-Smith
Notes et références
- ↑ « cyclopropane » sur ESIS, consulté le 15 février 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie
Catégories : Produit chimique extrêmement inflammable | Anesthésique | Cyclopropane
Wikimedia Foundation. 2010.