- Paradoxe de Loschmidt
-
Théorème H
Le théorème H est un théorème démontré par Boltzmann en 1872 dans le cadre de la théorie cinétique des gaz, lorsqu'un gaz hors d'équilibre vérifie son équation. Selon ce théorème, il existe une certaine grandeur H(t) qui varie de façon monotone au cours du temps, pendant que le gaz relaxe vers l'état d'équilibre caractérisé par la distribution de Maxwell.
Sommaire
Aspects historiques
La théorie cinétique des gaz, qui est basée sur l'application de la mécanique classique aux molécules constituant le gaz à l'échelle microscopique, s'est développée à partir des travaux fondateurs de Maxwell (1850) en parallèle avec la thermodynamique macroscopique. Boltzmann a contribué de façon marquante à la maturation de la théorie cinétique des gaz.
Il semblait tentant d'identifier la grandeur H(t), qui varie de façon monotone au cours du temps, à l'entropie (au signe près) introduite en thermodynamique par Clausius (1850) et qui, pour un système isolé, ne peut que croître d'après le second principe. Cette identification aurait permis de déduire le second principe, macroscopique, à partir des lois de la dynamique des molécules, microscopiques, conformément à l'approche réductionniste de la Nature.
Rapidement cependant, Loschmidt, puis Zermelo, formulèrent des critiques virulentes contre le théorème H, Boltzmann étant accusé de pratiquer des « mathématiques douteuses ». Cette accusation ne tient plus depuis un théorème rigoureux démontré par Lanford en 1973 (lire ci-dessous).
Le paradoxe de la réversibilité
Le paradoxe de Loschmidt (1876)
Loschmidt[1] se demande comment la grandeur H(t) peut-elle varier de façon monotone au cours du temps alors que les équations de la mécanique classique sont réversibles ? En effet, si la fonction H(t) était en train de décroitre et qu'à un instant donné, on renverse exactement toutes les vitesses de molécules, alors la nouvelle évolution se fait à l'envers, avec H(t) commençant par croitre. La réponse de Boltzmann fût brêve : « Allez-y, renversez les ! », signifiant l'impossibilité pratique d'une telle inversion exacte[2].
Interprétation statistique de l'entropie (Boltzmann-1877)
Article détaillé : EntropieEn 1877, Boltzmann proposa une nouvelle définition de l'entropie :
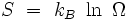
où kB est la constante de Boltzmann, et Ω le « nombre de complexions », c’est-à-dire le nombre de micro-états différents qui sont compatibles avec le macro-état thermodynamique donné.
La croissance de l'entropie devait alors être interprétée comme un phénomène statistique : l'entropie croît parce que le système évolue en général d'un état initial improbable (Ωi petit) vers un état final beaucoup plus probable (Ωf > Ωi). Des fluctuations locales sont bien sûr possibles, mais leur grandeur relative tend vers zéro lorsque le nombre N de molécules tend vers l'infini, de telle sorte que l'entropie d'un système macroscopique nous semble croître de façon monotone.
Inversion des vitesses & sensibilité aux conditions initiales
Avec la découverte du phénomène de sensibilité aux conditions initiales caractéristique des systèmes chaotiques, nous savons aujourd'hui qu'une inversion approchée des vitesses va rapidement entraîner une déviation par rapport à l'orbite initiale exacte inversée, et ce aussi petites que soient les erreurs introduites sur les conditions initiales. Des simulations numériques montrent alors qu'après une inversion approchée, la fonction H(t) commence bien par décroître comme le prédisait Loschmidt, mais qu'elle se remet très rapidement à croître à nouveau et ce pour presque toutes les conditions initiales approchées, l'orbite réelle du système différant de l'orbite initiale exacte inversée.
Le paradoxe de Zermelo
Le paradoxe de Zermelo (1896)
En 1890, alors qu'il étudie le problème à 3 corps en mécanique céleste, Poincaré démontre un théorème très général : le théorème de récurrence [3],[4]. Ce théorème dit que, pour presque toutes les conditions initiales, un système dynamique conservatif dont l'espace des phases est de volume fini[5] va repasser au cours du temps aussi près que l'on veut de sa condition initiale, et ce de façon répétée[6].
Zermelo[7] fait alors remarquer à Boltzmann en 1896 que le théorème de récurrence de Poincaré semble contredire le fait qu'une grandeur dynamique puisse varier de façon monotone, comme H(t) le fait. La réponse de Boltzmann[8] consiste à estimer le temps de récurrence moyen : pour un gaz macroscopique contenant
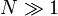 molécules, Boltzmann estime celui-ci d'ordre 10N, une durée qui est largement supérieure à l'age de l'univers[9] lorsque
molécules, Boltzmann estime celui-ci d'ordre 10N, une durée qui est largement supérieure à l'age de l'univers[9] lorsque 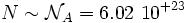 ; les récurrences sont donc invisibles à notre échelle.
; les récurrences sont donc invisibles à notre échelle.Le modèle des urnes d'Ehrenfest (1907)
Article détaillé : Modèle des urnes d'Ehrenfest.Le « modèle des urnes » est un modèle stochastique introduit en 1907 par les époux Paul & Tatiana Ehrenfest[10] pour clarifier les paradoxes précédents apparus à la fin du XIXe siècle dans les fondements de la mécanique statistique[11]. Ce modèle est parfois également appelé le « modèle des chiens & des puces[12] ». Le mathématicien Mark Kac a écrit[13] à son propos qu'il était :
« ... probablement l'un des modèles les plus instructifs de toute la physique ... »
Ce modèle est exactement soluble ; en particulier, on sait calculer le temps de récurrence moyen de chaque état, ainsi que sa variance pour certains états intéressants.
Le théorème de Lanford (1973)
Lanford a démontré rigoureusement[14] qu'un gaz de sphères dures dilué dans
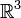 obéit à l'équation de Boltzmann dans la limite de Boltzmann-Grad, au moins pour un temps très court, égal seulement à un cinquième du temps de parcours moyen d'un atome[15].
obéit à l'équation de Boltzmann dans la limite de Boltzmann-Grad, au moins pour un temps très court, égal seulement à un cinquième du temps de parcours moyen d'un atome[15].En dépit de cette restriction sur la durée, ce théorème mathématique rigoureux est très important conceptuellement, puisque l'équation de Boltzmann entraine le théorème H. Il est donc aujourd'hui acquis que les mathématiques de Boltzmann ne sont pas « douteuses » !
Articles connexes
Bibliographie
Ouvrages de référence
- Anouk Barberousse ; La mécanique statistique - De Clausius à Gibbs, Collection Histoire des Sciences, Belin (2002),ISBN 2-7011-3073-5. Cette collection originale propose une histoire du développement de la théorie cinétique des gaz basée sur des extraits des grands textes fondateurs (traduits en français) mis en perspective contemporaine par une historienne des sciences (CNRS). Accessible dès le niveau premier cycle universitaire.
- Ludwig Boltzmann ; Leçons sur la théorie des gaz, Gauthier-Villars (1902-1905). Réédition Jacques Gabay (1987), ISBN 2-87647-004-7.
- Carlo Cercignani ; Ludwig Boltzmann - The man who Trusted Atoms, Oxford University Press (1998) 330 pp. ISBN 0-19-850154-4. Biographie scientifique du grand professeur Boltzmann, qui a porté la théorie cinétique des gaz à son acmée. Par un professeur de Physique Mathématique de l'Université de Milan (Italie), spécialiste de l'équation de Boltzmann. Niveau plutôt second cycle universitaire.
- Lawrence Sklar ; Physics and Chance - Philosophical Issues in the Foundations of Statistical Mechanics, Cambridge University Press (1995), ISBN 0-521-55881-6.
Bibliothèque virtuelle
Cours
- Noëlle Pottier ; Physique statistique hors d'équilibre : équation de Boltzmann, réponse linéaire., cours du DEA de Physique des Solides (Master 2) de la région parisienne (1999-2000). Fichiers PostScript
- Jean Bellissard ; Mécanique Statistique des Systèmes hors d'Équilibre, cours de Master 2, Université Paul Sabatier (Toulouse). pdf.
Articles
- Jos Uffink ; Boltzmann's Work in Statistical Physics, Stanford Encyclopedia of Philosophy (2004).
- Jos Uffink ; Compendium of the foundations of classical statistical physics, (2006), à paraître dans : Handbook for Philsophy of Physics, J Butterfield & J Earman (éditeurs) (2007). pdf.
- Sergio B. Volchan ; Probability as typicality, article soumis à : Studies in History and Philosophy of Modern Physics. ArXiv : physics/0611172.
- Joël L Lebowitz ; Macroscopic Laws, Microscopic Dynamics, Time's Arrow and Boltzmann's Entropy, Physica A 194 (1993), 1-27. pdf.
- Joël L Lebowitz ; Boltzmann's Entropy and Time's Arrow, Physics Today 46 (September 1993), 32-38. pdf. Contient également les réponses aux lecteurs publiées dans : Physics Today 47 (1994), 113-116.
- Joël L Lebowitz ; Microscopic Reversibility and Macroscopic Behavior: Physical Explanations and Mathematical Derivations, Turkish Journal of Physics 19 (1995), 1-20. Aussi dans : 25 Years of Non-Equilibrium Statistical Mechanics, Proceedings, Sitges Conference, Barcelona, Spain, 1994, dans : Lecture Notes in Physics, J.J. Brey, J. Marro, J.M. Rubí and M. San Miguel (eds.), Springer, 1995. Texas 96-163. ArXiv : cond-mat/9605183.
- Joël L Lebowitz ; Statistical Mechanics: A Selective Review of Two Central Issues, Reviews of Modern Physics 71 (1999), S346. ArXiv : math-ph/0010018.
- Joël L Lebowitz ; Microscopic Origins of Irreversible Macroscopic Behavior, Physica A 263 (1999), 516-527. Table ronde sur l'irréversibilité de la conférence STATPHYS20 (Paris, 22 juillet 1998). pdf.
- Joël L Lebowitz ; Microscopic Origins of Irreversible Macroscopic Behavior: An overview. Article de revue non publié ; pdf.
- Sheldon Goldstein & Joël L. Lebowitz ; On the (Boltzmann) Entropy of Nonequilibrium Systems, Physica D 193 (2004), 53-66. ArXiv : cond-mat/0304251.
- P.L. Garrido, Sheldon Goldstein & Joel L Lebowitz ; The Boltzmann Entropy for Dense Fluids Not in Local Equilibrium, Physical Review Letters 92 (2003), 050602. ArXiv : pdf.
- Joël L Lebowitz ; On the Microscopic Origin of Macroscopic Phenomena. Article pour le 40ème anniversaire du Center for Mathematical Physics, Trieste, Italie (2004). pdf.
Notes
- ↑ Johann Loschmidt ; Uber das Wärmegleichgewicht eines Systems von Körpern mit Rücksicht auf die Schwere, Sitzungsber. Kais. Akad. Wiss. Wien, Math. Naturwiss. Classe 73 (1876), 128-142 ; et : 75 (1877), 67.
- ↑ En fait, la théorie des gaz de Boltzmann n'est pas réversible, en raison d'une hypothèse dite du « chaos moléculaire » utilisée pour traiter les chocs entre deux molécules. Cette hypothèse dit que avant un choc, les deux vitesses de chaque molécule sont indépendantes, mais pas après ce choc.
- ↑ Henri Poincaré ; Sur le problème des trois corps et les équations de la dynamique, Acta Mathamatica 13 (1890), 1-270.
- ↑ Ludwig Boltzmann ; Uber einen mechanischen Satz von Poincaré, Wien. Ber. 106 (1897), 12.
- ↑ Par exemple, les molécules sont contenues dans un récipent de volume fini, excluant ainsi que les positions deviennent infinies. On supposera également que les vitesses restent toujours finies.
- ↑ Il existe quelques états exceptionnels pour lequel ceci n'est pas vérifié, mais ces état exceptionnels sont négligeables parmi tous les états possibles, et ce en un sens qui peut être rendu mathématiquement précis.
- ↑ Ernst Zermelo ; Uber einen Satz der Dynamik une der mechanischen Wärmetheorie, Wied. Ann. 57 (1896), 793.
- ↑ Ludwig Boltzmann ; Entgegnung auf die wärmetheoretische Betrachtung des Herrn Zermelo, Wied. Ann. \textbf{57} (1896), 773 ; et : \textbf{60} (1897), 392.
- ↑ Environ 15 milliards d'années.
- ↑ Paul Ehrenfest & Tatiana Ehrenfest ; Ueber zwei bekannte Eingewände gegen das Boltzmannsche H-Theorem, Zeitschrift für Physik 8 (1907), 311-314.
- ↑ Pour une revue des fondements conceptuels de la mécanique statistique à cette époque, on pourra lire l'article classique (paru initialement en allemand en 1912) : Paul & Tatiana Ehrenfest ; The Conceptual Foundations of the Statistical Approach in Mechanics, Dover, Inc. (1990), ISBN 0-486-66250-0. Niveau second cycle universitaire.
- ↑ D'après l'anglais : « dog-flea model ».
- ↑ Mark Kac ; Probability and Related Topics in Physical Science, Lectures in Applied Mathematics Series 1a, American Mathematical Society (1957), ISBN 0-8218-0047-7.
- ↑ Oscar E Lanford III ; Time Evolution of Large Classical Systems, dans : Dynamical Systems, Theory and Application, J. Moser (éditeur), Springer-Verlag (1975). Lire également : Oscar E Lanford III ; On a derivation of the Boltzmann equation, dans : Nonequilibrium phenomena I: The Boltzmann equation, Joël L Lebowitz & Elliott W Montroll (éditeurs), North-Holland (1983), 3-17.
- ↑ Temps moyen entre deux collisions consécutives.
- Portail de la physique
Catégories : Physique statistique | Théorème de physique
Wikimedia Foundation. 2010.
