- O2+
-
Dioxygényle
Le cation dioxygényle O2+ est un oxycation assez rare dans lequel chaque atome d'oxygène est à l'état d'oxydation +½. Il dérive formellement de l'oxygène moléculaire dont on a retiré un électron :
- O2 → O2+ + e−
L'énergie d'ionisation correspondante est particulièremen élevée, voisine de 1 165 kJ/mol[1].
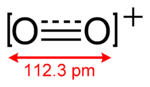
L'ion dioxygényle a une liaison d'ordre 2,5 et de longueur 112,3 pm mesurée dans l'hexafluoroarsénate de dioxygényle O2[AsF6][2]. Il a le même nombre d'électrons de valence que le monoxyde d'azote NO. Son énergie de liaison est de 625,1 kJ/mol[3].
Ce cation a joué un rôle déterminant dans la synthèse, en 1962, du premier composé covalent d'un gaz rare, en l'occurence l'hexafluoroplatinate de xénon XePtF6. En effet, l'hexafluorure de platine PtF6 réagit avec l'oxygène O2 pour donner de l'hexafluoroplatinate de dioxygényle O2PtF6 :
- O2 + PtF6 →
L'hexafluorure de platine est l'un des rares agents oxydants capables d'oxyder l'oxygène, et c'est ce qui a permis à Neil Bartlett d'oxyder le xénon pour produire de l'hexafluoroplatinate de xénon XePtF6.
L'hexafluorure d'arsenic AsF6 est également capable d'oxyder l'oxygène en hexafluoroarsénate de dioxygényle O2[AsF6][4].
Notes et références
- ↑ Michael Clugston; Rosalind Flemming (2000). Advanced Chemistry, Oxford University Press, ISBN 0199146330, ISBN 9780199146338, p. 355
- ↑ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4, p. 616
- ↑ J. Shamir, J. Binenboym, H. H. Claassen, « The vibrational frequency of the O2+ cation », dans Journal of the American Chemical Society, vol. 90, no 22, 1968, p. 6223−6224 [lien DOI]
- ↑ A. R. Young, T. Hirata, S. I. Morrow, « The Preparation of Dioxygenyl Salts from Dioxygen Difluoride », dans J. Am. Chem. Soc., vol. 86, no 1, 1964, p. 20−22 [lien DOI]
Article connexe
- Chimie des gaz nobles pour la synthèse du XePtF6.
- Portail de la chimie
Catégories : Cation | Composé de l'oxygène
Wikimedia Foundation. 2010.