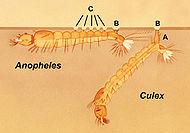
- Anophèle
-
 Anophèle
Anophèle
Anopheles gambiae femelle lors d'un repas sanguin Classification Règne Animalia Embranchement Arthropoda Classe Insecta Ordre Diptera Sous-ordre Nematocera Famille Culicidae Sous-famille Anophelinae Genre Anopheles
(Meigen 1818)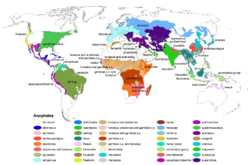
Carte de distribution des anophèles

D'autres documents multimédia
sont disponibles sur CommonsLe genre Anopheles (nom commun du genre masculin : anophèle [1]) regroupent les moustiques de l'ordre des Diptera, de la famille des Culicidae, sous-famille des Anophelinae. Cette dernière sous-famille comportent également deux autres genres : Bironella et Chagasia, numériquement bien moins nombreux.
Il est responsable de la transmission du paludisme aux animaux homéothermes (cf. section détaillée : « Vecteur biologique »). Cependant, si 464 espèces d'anophèles sont actuellement identifiés seules 68 d'entre elles sont des espèces vectrices responsables de la transmission du parasite Plasmodium à l'être humain[1]. Ces vecteurs sévissent principalement en Afrique subsaharienne, en Asie et en régions néo-tropicales[2].
Nombre d'anophèles jouent aussi un rôle considérable dans la transmission d'autres parasites comme Wuchereria bancrofti et Brugia malayi les agents de la filariose lymphatique[3].
Anopheles funestus et Anopheles gambiae sont les seuls anophèles également vecteurs d'un arbovirus du genre alphavirus. Ils ont joué un rôle majeur dans les épidémies dues au virus O'nyong-nyong en Afrique subsaharienne au départ de l'Ouganda[4]. A. funestus est aussi impliqué dans la propagation de la maladie du chikungunya, du yando, de la tataguine[5] et du sindbis[6].
Sommaire
Étymologie
Le mot latin a été créé par Johann Wilhelm Meigen, venant du grec ancien anôphelês qui signifie « inutile » (par la combinaison du an (αν) privatif et de ôphelès (ωφελής) signifiant « utile »). C'est Georges Cuvier qui, en 1829, francise ce terme en « anophèle »[7].
Systématique
- genre Anopheles (Meigen, 1818) : 7 sous-genres, 464 espèces ; présence sur les cinq continents. Seul ce genre comporte des espèces vectrices du paludisme ;
- sous-genre Anopheles (Meigen, 1818) : 182 espèces ; sur les cinq continents sauf en écozone afrotropicale et en péninsule Arabique. Ce sous genre comprend les vecteurs atroparvus, labranchiae, maculipennis, sacharovi, messeae, freeborni, hermsi, quadrimaculatus, pseudopunctipennis, vestitipennis, sinensis, barbirostris, etc ;
- sous-genre Cellia (Theobald, 1902) : 219 espèces ; ancien monde et écozone australasienne. Il comprend les vecteurs les plus importants gambiae, funestus,nili, moucheti et des vecteurs locaux ou secondaires :ovengensis, pharoensis, sergentii, stephensi, maculatus, farauti, dirus, subpictus, superpictus, sundaicus, minimus, balabacensis, culicifacies etc ;
- sous-genre Kerteszia (Komp, 1937) : 12 espèces ; Amérique du Sud. Il est inféodé aux bromeliacées au vu de son écologie larvaire et comprend A. bellator ;
- sous-genre Lophodomyia (Antunes, 1937) : 6 espèces ; régions néo-tropicales ;
- sous-genre Nyssorhynchus (Blanchard) : 38 espèces ; nouveau monde sauf Australie. Il comprend les vecteurs albimanus, albitarsis, aquasalis, darlingi, nuneztovari, etc ;
- sous-genre Stethomyia (Edwards, 1932) : 5 espèces ; régions néo-tropicales ;
- sous-genre Baimaia (Harbach, 2005) : 1 espèce ; sud-est asiatique.
Biologie
Cycle de vie
Comme tous les moustiques, les anophèles passent par quatre stades dans leur cycle de vie : le stade zygotique, le stade larvaire, le stade pupaire et, enfin, le stade imagal (adulte). Les trois 1er stades se déroulent en milieu aquatique et durent, en tout, entre 7 jours et 5 semaines selon l'espèce et, surtout, la température ambiante. le stade adulte se déroule en milieu aérien et durent environ une semaine pour le mâle et jusqu'à deux mois pour la femelle.
Stade zygotique
Les femelles adultes sont des ovipares et pondent de 50 à 200 œufs. Ces derniers mesurent de ~ 0.5 x 0.2 mm et sont pondus séparément par oviposition (fait de déposer les œufs à un certain endroit) directement sur l'eau. Ces œufs n'ont pas d'oothèque et possèdent des flotteurs latéraux. Peu résistants à la sécheresse, ils éclosent en 2 à 3 jours en climat tropical et en 2 à 3 semaines en climat tempéré.
Activité d'une larve d'anophèle (longueur ~ 8 mm)
Stade larvaire
Les larves s'alimentent et se maintiennent au repos sous la surface de l’eau, respirant par leurs stigmates situés sur l'avant dernier segment abdominal. Elles doivent pour respirer se maintenir parallèles à la surface de l’eau, ce qui est caractéristique de cette sous famille. Cette position est assurée grâce à des poils hydrophobes ressemblant à des palmiers et situés sur le dos de l'abdomen.
Les larves d'anophèles (comme tous les Culicidae) se différencient des autres insectes aquatiques par l'absence de pattes. Elles sont clairement constituées de trois parties :
- une tête pourvue d'une paire de mandibules armées de dents sur leur bord distal (bord le plus éloigné de la tête (en opposition à « proximal »)) et qui forment avec le labium (pièce buccale faisant partie de la langue) l'appareil masticateur. L'ensemble est flanqué d’une paire de brosses buccales qui entraînent les aliments vers cet appareil. Cette tête peut tourner à 180° afin d'attraper les particules de nourriture flottant à la surface de l'eau ;
- un thorax plus large que la tête ;
- un abdomen pourvu de neuf segments. Le 8e comporte le siphon respiratoire et le 9e des cils.
Les larves passent la majeure partie de leur temps à s'alimenter d'algues, de bactéries, et d'autres micro-organismes juste sous la surface de l'eau. Leur pigmentation externe est en mimétisme avec le milieu aquatique où elles vivent. Plongeant seulement si elles sont perturbées, elles nagent par des mouvements saccadés du corps entier ou par propulsion grâce à leurs brosses buccales.
L'anophèle est un holométabole dont la larve passe par 3 exuviations (mues de croissance) la menant d'une longueur de ~ 1 mm au stade 1 à ~ 5–8 mm au stade 4. La durée du processus dépend de la température ambiante avec un minimum de 5 jours.
 Une pupe d'anophèle avec en haut à gauche les 2 trompettes respiratoires
Une pupe d'anophèle avec en haut à gauche les 2 trompettes respiratoires
Stade nymphal
C'est le stade le plus critique pour l'anophèle qui est exposé aux variations climatiques et aux prédateurs sans possibilité de réaction.
La pupe[8], vue latéralement, ressemble à une virgule. la pupaison se réalise à l'intérieur de la cuticule[9] du dernier stade larvaire qui n'est pas rejetée mais qui se durcit et devient un cocon abritant l'ensemble des transformations de la métamorphose. La tête et le thorax sont fusionnés dans un céphalothorax et l'abdomen courbé vers le bas. Bien qu'elle ait cessé de se nourrir, tout comme la larve, la pupe est obligée de venir fréquemment à la surface de l'eau pour respirer, ce qu'elle fait grâce à une paire de trompes situées au sommet du céphalothorax. Après quelques jours, la surface dorsale du puparium (capsule durcie qui enveloppe la pupe) se fend longitudinalement en deux à hauteur du céphalothorax et l'imago émerge alors de l'exuvie du dernier stade larvaire.
Stade imaginal
L'adulte possède un corps effilé constitué de 3 sections :
- la tête spécialisée pour acquérir l'information sensorielle et pour l'alimentation. Elle contient les yeux composés et une paire d'antennes segmentées et plumeuses (plus chez le mâle). Celles-ci sont importantes, aussi bien, pour détecter les odeurs de nourriture, pour les 2 sexes, que les animaux homéothermes et les sites de ponte pour les femelles. La tête comporte également :
- le thorax est spécialisé dans la locomotion. Il comprend :
- trois paires de pattes uniramées ;
- une paire d'ailes nervurées attachées au mésothorax. Elles servent au vol proprement dit ;
- une paire d'haltères attachées au métathorax. Elles aident l'insecte à améliorer son équilibre en vol en agissant à la manière de gyroscopes.
- Le thorax comporte, également, une partie des stigmates et enferme l'estomac.
- l'abdomen, qui contient le cœur et l'autre partie des stigmates, est spécialisé dans :
- la digestion;
- la reproduction.
- Il est composé de 8 segments eux-mêmes constitués de 2 parties : le tergite (partie dorsale) et le sternite (partie ventrale) plus un 9e segment qui renferme l'appareil reproducteur chez les 2 sexes.
La durée de vie de l'adulte est entre 6 jours et 1 mois, voire plus pour la femelle et environ 5 jours pour le mâle. Chez certaines espèces, les femelles peuvent survivre plus de 3 mois en état de diapause (hibernation) comme A. superpictus ou en état d'estivation comme A. arabiensis pendant les périodes de chaleur et de sécheresse intense au Soudan.
Mâles et femelles se nourrissent de nectar et de jus de plante car ils ont besoin de sucres comme source d'énergie. Les femelles sont aussi hématophages. Elles doivent prendre un repas sanguin, voire 2 ou 3 s'il s'agit de femelles nullipares, afin de permettre aux œufs de se développer dans les ovaires.
Reproduction
La copulation a lieu dans les 24 à 48 h suivants l'émergence de l'adulte.
Les femelles ne s'accouplent qu'une seule fois au cours de leur existence. Les spermatozoïdes sont stockés dans une spermathèque, dont ils sont extraits progressivement pour féconder la totalité des œufs qu'elles produisent pendant le reste de leur vie.
Technique de chasse de l'imago femelle
La copulation terminée, les femelles cherchent leur 1er repas sanguin dès le crépuscule et en continuant pendant la nuit jusqu'à ce qu'elles l'aient trouvé. Le repas dure de 2 à 3 min et la quantité de sang ingérée varie de 1 à 2,5 µl. Certaines espèces, comme An. albimanus, sont exophagiques (c'est-à-dire qu'elles préfèrent prendre leur repas à l'extérieur des bâtiments) et d'autres, comme A. gambiae, sont endophagiques (à l'intérieur des bâtiments). Une autre différenciation dans le comportement de l'anophèle est son degré d'anthropophilie (vivant plutôt dans un milieu habité par l'homme) ; A. gambiae et A. culicifacies piquent essentiellement les humains et rarement le bétail, alors qu'A. culifacies pique aussi bien le bétail que les humains.
Lorsque les humains ou les animaux respirent, ils produisent du CO2 et leur corps dégage constamment de la chaleur et de l'humidité (transpiration) ainsi que beaucoup d'autres kairomones comme l'acide lactique ou le sébum. Les odeurs de certaines hormones secrétées par la femme enceinte sont aussi très attirantes.
Les moustiques, ainsi que d'autres insectes piqueurs, sont capables de détecter toutes ces émanations depuis de longues distances (± 20 m pour le CO2). Les femelles sont immédiatement attirées par ces sources alors qu'elles sont repoussantes pour les mâles. Elles sont également attirées par les vapeurs d'alcool ou par les couleurs foncées, et plus spécialement le noir. Pour ce faire, elles volent de-ci de-là (maximum 2 km) en utilisant leurs capteurs pour détecter, en premier lieu, les kairomones, ensuite le CO2, et enfin la température relative et les facteurs visuels. Les kairomones attractifs varient d'une espèce à l'autre. Ainsi, A.gambiae qui est plus attiré par les kairomones émanant des pieds et des chevilles a l'habitude de voler au ras du sol[11],[12].
Embryogenèse et ponte
Après avoir gonflé leur abdomen avec le sang, les femelles doivent trouver un endroit favorable pour se reposer et digérer ce sang, soit à l'intérieur des maisons (pour les espèces endophages) soit à l'extérieur des maisons dans toute une série d'abris naturels (pour les espèces exophages). Cette digestion est activée par des enzymes digestives comme la trypsine et s'effectue, protégée par la membrane péritrophique (sorte de manchon très mince fabriqué par un organe musculaire appelé proventricule), dans l'estomac. Elle est couplée au développement des zygotes et prend une quarantaine d'heures. Pendant cette période, l'abdomen enfle encore et passe d'une teinte rougeâtre à une teinte blanchâtre lorsque les œufs ont atteint leur maturité. La femelle part alors à la recherche d'une nappe d'eau pour y pondre. Le choix dépendant de la présence ou non de végétation aquatique, de l'ensoleillement, de la qualité de l'eau (douce ou saumâtre) (cf. section détaillée : « Écologie »).
La séquence (repas sanguin, maturation des œufs et ponte) est répétée plusieurs fois au cours de la vie du moustique et s'appelle le cycle trophogonique. La durée de ce cycle dépend de l'espèce, mais surtout de la température externe. Chez A. gambiae, le cycle prend 48 heures lorsque la moyenne de température jour/nuit est de 23 °C.
Écologie
- Afrique :
- Les principaux vecteurs pour l'homme sont : A. gambiae s.str.[13], A. arabiensis (espèce indifférenciable morphologiquement du précédent car faisant partie de la même section Anopheles gambiae), A. funestus, A. nili et A. moucheti. D’autres tels que A. melas, A. merus, A. paludis, A. pharoensis, A. hancocki sont des vecteurs d’importance locale en Afrique centrale.
- Chacune de ces espèces a des exigences écologiques particulières et exploite une variété de surfaces aquatiques pour leur ponte ;
- A. gambiae s.str.[13] se développe plutôt dans de petites collections temporaires d’eaux claires, ensoleillées et sans végétation. Il ne peut guère vivre au-delà de 1 000 m d'altitude ;
- A. arabiensis peuple les environnements plus secs jusqu’en bordure du Sahara[14] ;
- A. funestus peuple les marais permanents ou semi-permanents ainsi que les étangs. Il est moins sensible à la sècheresse et l'adulte sera plus abondant en de telles périodes que A. gambiae s.str.[13]. De plus, il est parfaitement adapté pour vivre jusqu'à 2 000 m[15] ;
- A. nili se développe sur les bords des rivières à courant rapide ;
- A. moucheti se développe dans les fleuves à courant lent, dans le bloc forestier d’Afrique centrale[16] ;
- Certaines espèces comme A. melas et A. merus (tous 2 font également partie de la section Anopheles gambiae) se développent dans les eaux saumâtres des zones côtières tolérant une concentration en sel comprise entre 5 à 37 g par ℓ.
- Amériques : A. darlingi, A. albimanus, A. pseudopunctipennis, A. freeborni, A. nuneztovari et A. quadrimaculatus.
- Asie : A. culicifacies, A. fluviatilis, A. dirus, A. acconitus, A. leucosphyrus, A. maculatus et A. minimus.
- Australie : A. farauti type1 et A. farauti type 2 ; uniquement sur les côtes du nord.
- Europe : A. atroparvus, A. labranchiae, A. sacharovi, A. sinensis, A. superpictus et A. pattoni.
L'énigme des Seychelles
Une recherche systématique, réalisée en décembre 2008 par un chercheur de l'Institut de recherche pour le développement (IRD), sur la présence ou non d'anophèles sur six des 115 îles de l'archipel des Seychelles, dont Mahé, s'est terminée sur l'évidence de leur absence. Une des conclusions des scientifiques est que la présence d’Anopheles dépend directement de celle de mammifères terrestres indigènes[17].
Vecteur biologique
L'anophèle femelle est le vecteur du parasite Plasmodium de la malaria ainsi que son hôte définitif (la reproduction sexuée du parasite a lieu dans le corps de l'insecte). Les jeunes imagos ingèrent le parasite pour la première fois lorsqu'ils se nourrissent du sang d'un animal homéotherme infecté. Le moustique transporte ensuite les gamétocytes du Plasmodium dans ses glandes salivaires. Une fois déglutis, ils passent dans le sang en traversant l'épithélium salivaire pour se différencier en gamètes mâles et femelles qui s'unissent pour former un zygote mobile appelé ookinète qui pénètre la paroi stomacale pour devenir un oocyste sphérique dont le noyau va se diviser sans fin pour former des sporozoïtes. La durée de cette maturation est étroitement dépendante de la température extérieure. Par exemple, pour Plasmodium falciparum : pas de maturation en dessous de 18 °C ou au-dessus de 35 °C, elle est maximale vers 24 °C. Quand l'oocyste rompt, il relâche les sporozoïtes qui migrent dans le corps de l'anophèle jusqu'aux glandes salivaires d'où ils peuvent, lors d'un nouveau repas de sang, infecter un nouvel hôte primaire[18],[19], en traversant la peau, avec la salive contenant aussi des anticoagulants et des enzymes.
Plusieurs études récentes tel que celle d'une collaboration scientifique entre la France, le Kenya et la Suisse[20], danoise[21] ou encore de l'université Paris VI[22] suggèrent une manipulation du comportement de l’anophèle par Plasmodium. L'anophèle serait plus attiré par les humains porteur du stade infectieux du paludisme pour lui-même (stade gamétocytaire). Ce comportement favoriserait la propagation du parasite à travers son hôte définitif.
D'autre part, l'anophèle portant le stade transmissible aux humains (stade sporozoïtaire) aurait tendance à augmenter son taux de piqûre quotidien, favorisant cette fois-ci la propagation du parasite à travers son hôte intermédiaire. En outre, Plasmodium modifierait la valeur sélective de l'anophèle de façon à augmenter sa durée de vie en diminuant son succès reproductif, ce qui favoriserait encore une fois le taux de chance, pour Plasmodium, de passer d’un hôte à l'autre[23].Le contrôle des vecteurs de la malaria permettrait de contrôler la maladie de façon non intrusive. De plus, les utilisations d’insecticides sur les moustiquaires (ITNs) et dans les intérieurs (IRS) font partie de la lutte pour l’éradication de la malaria. Les ITNs sont donc une barrière physique et chimique pour empêcher le moustique d’atteindre sa cible (l’être humain). L’IRS est utile également car le moustique reste à l’intérieur après avoir pris son repas sanguin et sera donc exposé longuement à l’insecticide. Ces deux méthodes ciblent les moustiques adultes et ont déjà prouvé leur efficacité en réduisant les cas de malaria[24]
Liste non exhaustive des espèces
- Anopheles acanthotorynus (Komp, 1937)
- Anopheles albimanus (Wiedemann, 1820)
- Anopheles albitarsis (Lynch Arribalzaga)
- Anopheles amictus (Edwards)
- Anopheles annulipalpis (Lynch Arribalzaga, 1878)
- Anopheles anomalophyllus (Komp, 1936)
- Anopheles antunesi (Galvao et Amaral, 1940)
- Anopheles apicimacula (Dyar et Knab, 1906)
- Anopheles aquasalis (Curry, 1932)
- Anopheles arabiensis (Patton, 1905)
- Anopheles argyritarsis (Robineau-desvoidy, 1827)
- Anopheles atropos (Dyar et Knab, 1906)
- Anopheles aztecus (Hoffmann, 1935)
- Anopheles bambusicolus (Komp, 1937)
- Anopheles barberi (Coquillett, 1903)
- Anopheles bellator (Dyar et Knab, 1906)
- Anopheles benarrochi (Gabaldon, Cova-gar. et Lop, 1941)
- Anopheles boliviensis (Theobald, 1905)
- Anopheles bonnei (Fonseca et Ramos, 1939)
- Anopheles bradleyi (King, 1939)
- Anopheles braziliensis (Chagas, 1907)
- Anopheles bustamentei (Galvao, 1955)
- Anopheles canorii (Flock et Abonnene, 1945)
- Anopheles carnevalei (Brunhes, Le Goff et Geoffroy, 1999)
- Anopheles crucians (Wiedemann, 1828)
- Anopheles cruzii (Dyar et Knab, 1908)
- Anopheles darlingi (Root, 1926)
- Anopheles earlei (Vargas, 1943)
- Anopheles eiseni (Coquillett, 1902)
- Anopheles evandroi (Lima, 1937)
- Anopheles evansae (Brethes, 1926)
- Anopheles farauti (Laversan)
- Anopheles fausti (Vargus, 1943)
- Anopheles fluminensis (Root, 1927)
- Anopheles franciscanus (Mccracken, 1904)
- Anopheles freeborni (Aitken)
- Anopheles funestus
- Anopheles gabaldoni (Vargus, 1941)
- Anopheles galvaoi (Causay, Deane et Deane, 1943)
- Anopheles gambiae s.str.[13] (Giles, 1902)
- Anopheles georgianus (King, 1939)
- Anopheles gilesi (Peryassu, 1908)
- Anopheles gomezdelatorrei (Levi-castillo, 1955)
- Anopheles grabhami (Theobald)
- Anopheles guarao (Anduze et Capdevielle, 1949)
- Anopheles hectoris (Giaquinto-Mira, 1931)
- Anopheles homunculus (Komp, 1937)
- Anopheles ininii (Senevet et Abonnenc, 1938)
- Anopheles intermedius (Peryassu, 1908)
- Anopheles judithae (Zavortink, 1969)
- Anopheles kompi (Edwards, 1030)
- Anopheles lanei (Galvao et Amaral, 1938)
- Anopheles lutzii (Cruz, 1901)
- Anopheles maculipes (Theobald, 1903)
- Anopheles mattogrossensis (Lutz et Neiva, 1911)
- Anopheles mediopunctatus (Theobald, 1903)
- Anopheles melas (Theobald, 1903)
- Anopheles merus (Donitz, 1902)
- Anopheles minor (Lima, 1929)
- Anopheles neivai (Dyar et Knab, 1913)
- Anopheles neomaculipalpus (Curry, 1932)
- Anopheles nigritarsis (Chagas, 1907)
- Anopheles nimbus (Theobald, 1902)
- Anopheles noroestensis (Galvao et Lane, 1937)
- Anopheles nuneztovari (Galaldon, 1940)
- Anopheles occidentalis (Dyar et Knab, 1906)
- Anopheles oiketorakras (Osorno-Mesa, 1947)
- Anopheles oswaldoi (Peryassu, 1922)
- Anopheles ovengensis (Awono et al, 2004)
- Anopheles parapunctipennis (Martini, 1932)
- Anopheles parvus (Chagas, 1907)
- Anopheles perplexens (Ludlow, 1907)
- Anopheles peryassui (Dyar et Knab, 1908)
- Anopheles pictipennis (Philippi, 1865)
- Anopheles pseudomaculipes (Peryassu, 1908)
- Anopheles pseudopunctipennis (Theobald, 1901))
- Anopheles pseudotibiamaculatus (Galvao et Barretto, 1941
- Anopheles punctimacula (Dyar et Knab, 1906)
- Anopheles punctipennis (Say, 1823)
- Anopheles punctulatus
- Anopheles quadriannulatus (Theobald, 1911)
- Anopheles quadrimaculatus (Say, 1824)
- Anopheles rachoui (Galvao, 1952)
- Anopheles rangeli (Gabald., Covo-gar. et Lopez, 1940)
- Anopheles rondoni (Neiva et Pinto, 1922)
- Anopheles zboubii (Eichinger et al, 1985)
- Anopheles sanctielii (Senevet et Abonnenc, 1938)
- Anopheles shannoni (Davis, 1931)
- Anopheles squamifemur (Antunes, 1937
- Anopheles thomasi (Shannon, 1933)
- Anopheles tibiamaculatus (Neiva, 1906)
- Anopheles triannulatus (Neiva et Pinto, 1922)
- Anopheles vargasi (Gabald., Covo-gar. et Lopez, 1941)
- Anopheles vestitipennis (Dyar et Knab, 1906)
- Anopheles walkeri (Theobald, 1901)
- Anopheles xelajuensis (Leon, 1938)
Articles connexes
Notes et références
- (fr) Sanofi Aventis - Critères taxonomiques des (anophèles) adultes ; 1er octobre 2008 [lire en ligne]
- (en) G. Macdonald, The Epidemiology and Control of Malaria - Zones de distribution des anophèles responsable du paludisme [lire en ligne]
- (en) Chapman & Hall, Medical Insects and Arachnids (pp. 120-240) - Vecteurs de la filiarose lymphatique [lire en ligne]
- (fr) CRORA (Centre collaborateur OMS de référence et de recherche sur les arbovirus) - Informations sur l'épidémie de O'nyong-nyong de 1959 à 1963 [lire en ligne]
- Institut Pasteur ; « Tataguine (Ar D 252) » [lire en ligne]
- IRD ; « Les facteurs de risques naturels » [lire en ligne]
- Source : Alain Rey (1994). Dictionnaire historique de la langue française. 2 volumes. Le Robert (Paris) : xxii + 2387 p.
- (fr) Encyclopédie des ravageurs européens - Définition du terme « pupe » [lire en ligne]
- La cuticule désigne la couche externe sécrétée par l'épiderme des arthropodes. Elle ne comporte pas de cellules et constitue leur exosquelette. Chez les insectes, elle est en général formée de trois couches.
- Chez des insectes suceurs, le rostre est la pièce buccale modifiée pour percer et aspirer.
- Science & Vie du 6 décembre 2009 : L'anophèle piégé par une chaussette sale [(fr) lire en ligne]
- Effet de Terre du 1e septembre 2007 : L’anophèle a un talon d’achille [(fr) lire en ligne]
- Sensu stricto (ou stricto sensu) est une locution latine qui signifie au sens strict et dont l'abréviation est s.str. En biologie, cette locution indique qu'un taxon doit pris au sens strict.
- (en) Sanofi Aventis - Anopheles arabiensis ; Économie biologique et importance médicale ; 1er février 2009 [lire en ligne]
- (en) The American Journal of Tropical Medecine & Hygiene - Population genetic structure of the African malaria Mosquito anopheles funestus in Kenya - 2003 [lire en ligne]
- (en)Institut de recherche pour le développement - Distribution and larval habitat characterization of Anopheles moucheti, Anopheles nili, and other malaria vectors in river networks of southern Cameroon par Antonio-Nkondjio C., Ndo C., Costantini Carlo, Awono-Ambene Parfait, Fontenille Didier et Simard Frédéric ; 2009 [lire en ligne]
- Institut de recherche pour le développement : « Paludisme : pourquoi les Seychelles sont-elles indemnes ? », fiche d'actualité n° 308 de février 2011, Rédaction DIC – Gaëlle Courcoux, [lire en ligne]
- Talman A, Domarle O, McKenzie F, Ariey F, Robert V, « Gametocytogenesis: the puberty of Plasmodium falciparum », dans Malar J, vol. 3, p. 24.
- Entomologie du paludisme et contrôle des vecteurs ; Trans. du paludisme (pages 7 et 8)-OMS 2003[lire en ligne]
- PLOS Biology, « Malaria Infection Increases Attractiveness of Humans to Mosquitoes », Lacroix et al., 2005 [(en) lire en ligne (page consultée le 8 octobre 2011)]
- The Royal Society « The effect of Plasmodium yoelii nigeriensis infection on the feeding persistence of Anopheles stephensi Liston throughout the sporogenic cycle », Anderson et al., 1999 [(en) lire en ligne (page consultée le 8 octobre 2011)]
- J. C. Koella 1999 « An evolutionary view of the interactions between anopheline mosquitoes and malaria parasites » dans Microbes and Infection, Vol 1, p. 303-308, Elsevier Paris, 1999
- Centre for Applied Entomology and Parasitology, School of Life Sciences, Huxley Building, Keele University, « Ecological immunology of mosquito–malaria interactions », Auteurs : Frédéric Tripet, Fred Aboagye-Antwi et Hilary Hurd, mai 2008 [(en) lire en ligne (page consultée le 8 octobre 2011)]
- Protopopoff et al. Vector control in a malaria epidemic occurring within a complex emergency situation in Burundi: a case study. Malaria Journal 2007, 6:93.
Liens externes
Catégories :- Diptère (nom vernaculaire)
- Insecte vecteur
- Culicidé
- genre Anopheles (Meigen, 1818) : 7 sous-genres, 464 espèces ; présence sur les cinq continents. Seul ce genre comporte des espèces vectrices du paludisme ;
Wikimedia Foundation. 2010.