- Aniline
-

Cet article possède un paronyme, voir : Alanine. Aniline 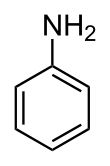
Structure de l'aniline.Général Synonymes Phénylamine
Aminobenzène
BenzèneamineNo CAS No EINECS PubChem ChEBI SMILES InChI Apparence liquide incolore, huileux, d'odeur caractéristique. Devient brun lors d'exposition à l'air ou la lumière[1]. Propriétés chimiques Formule brute C6H7N [Isomères] Masse molaire[4] 93,1265 ± 0,0055 g·mol-1
C 77,38 %, H 7,58 %, N 15,04 %,pKa 4,62 Moment dipolaire 1,13 ± 0,02 D [2] Diamètre moléculaire 0,562 nm [3] Propriétés physiques T° fusion -6 °C[1] T° ébullition 184 °C[1] Solubilité dans l'eau à 20 °C : 34 g·l-1[1],
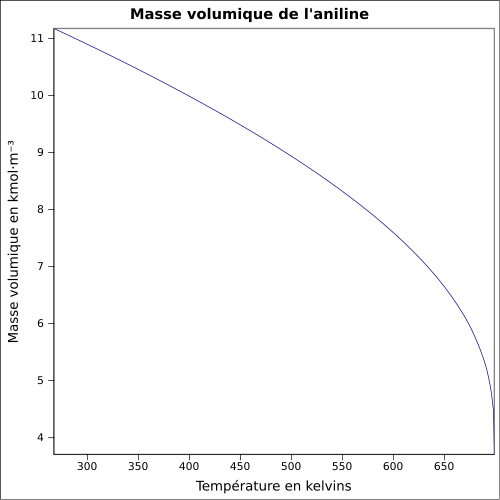
Miscible dans l'éthanol et l'acétoneMasse volumique 1,02 g·cm-3[1],
Densité du gaz : 3,2 (air=1)
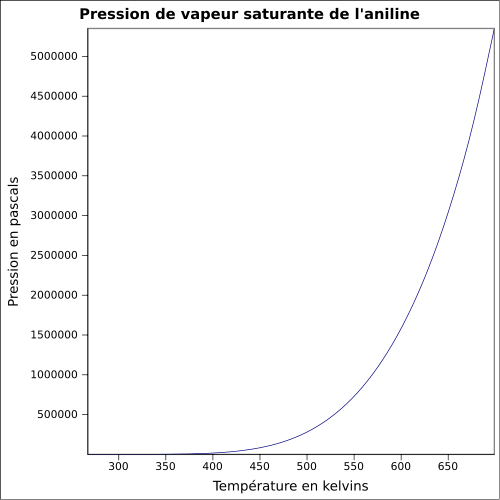
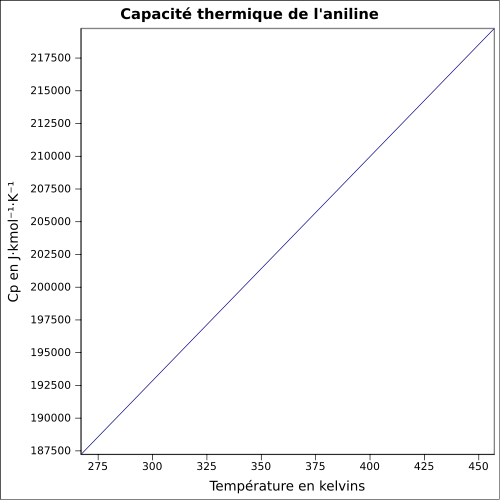
T° d'auto-inflammation 615 °C[1] Point d’éclair 70 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,2–11 %vol[1] Pression de vapeur saturante à 20 °C : 40 Pa[1] Viscosité dynamique 3,71 cP à 25 °C Point critique 53,1 bar, 425,85 °C [6] Thermochimie Cp Cristallographie Classe cristalline ou groupe d’espace P21/c [8] Paramètres de maille a = 21,822 Å
b = 5,867 Å
Z = 8 [8]
c = 8,386 Å
α = 90,00 °
β = 101,01 °
γ = 90,00 °Volume 1 053,89 Å3 [8] Densité théorique 1,174 [8] Propriétés optiques Indice de réfraction  1,583 [3]
1,583 [3]Précautions Directive 67/548/EEC 
T
NPhrases R : 23/24/25, 40, 41, 43, 48/23/24/25, 50, 68, Phrases S : (1/2), 26, 27, 36/37/39, 45, 46, 61, 63, Transport - 1547 NFPA 704 SIMDUT[10] 

SGH[11] 



DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[9] Inhalation Vertiges,
convulsions,
vomissements,
perte de consciencePeau Rougeurs Yeux Rougeur, douleur Ingestion Toxique Écotoxicologie LogP 0,94[1] DJA 7 μg/kg p.c./jour[12] Seuil de l’odorat bas : 0,58 ppm
haut : 10 ppm[13]Unités du SI & CNTP, sauf indication contraire. L’aniline, connue également comme phénylamine ou aminobenzène, est un composé organique aromatique de formule chimique C6H5NH2. C'est une amine primaire aromatique dérivée du benzène, toxique pour l'homme et l'environnement.
Dérivés : chloroanilines, dichloroanilines, trichloroanilines...
Sommaire
Historique
L'aniline a été isolée pour la première fois en 1826 par Otto Unverdorben par distillation de l'indigo. Celui-ci la baptisa crystalline.
En 1834, Friedrich Runge parvint à isoler du goudron de houille une substance qui une fois traitée par du chlorure de chaux prend une couleur bleue. Il la baptisa kyanol ou cyanol.
En 1841, C. J. Fritzsche obtint une substance huileuse en traitant de l'indigo avec de la potasse, qu'il baptisa aniline, d'après le nom d'une plante produisant de l'indigo, Indigofera anil. Le mot « anil » est lui même issu des termes sanskrits nīla, bleu profond, et nīlā plante d'indigo. A peu près en même temps, N.N. Zinin découvrit que la réduction du nitrobenzène permet d'obtenir une base qu'il baptisa benzidam. Par la suite, August Wilhelm von Hofmann étudia ces différentes substances et démontra en 1855 qu'elles sont identiques. La première utilisation d'aniline à l'échelle industrielle concerna la fabrication de la mauvéine, un colorant violet découvert en 1856 par William Henry Perkin.Propriétés physico-chimiques
L'aniline, liquide à la température ambiante, est une substance huileuse incolore. A l'air, elle peut s'oxyder lentement et former une résine de couleur rouge-brune. L'aniline d'odeur désagréable est aisément inflammable.
L'aniline est une base faible ; Les amines aromatiques sont généralement des bases nettement plus faibles que les amines aliphatiques. En effet, le doublet porté par l'atome d'azote est en partie délocalisé (mésomérie), ce qui n'est plus le cas sous la forme protonée (forme acide) où le doublet est localisé sur la liaison N-H. La forme basique est donc plus stabilisée par mésomérie que la forme acide, d'où une constante d'acidité abaissée. Elle réagit avec les acides forts en formant des sels contenant l'ion anilinium (C6H5-NH3+). Elle réagit également avec les halogénures d'acyle (comme par exemple le chlorure d'éthanoyle CH3COCl) en formant des amides. Les amides formées à partir de l'aniline sont parfois nommés anilides : CH3-CO-NH-C6H5 est par exemple l'acétanilide.
L'aniline réagit avec les iodures d'alkyle en formant des amines secondaires ou tertiaires.
Oxydation : En solution basique, l'aniline réagit pour former de l'azobenzène. L'acide chromique permet de la transformer en quinone. Elle réagit avec les ions chlorates en présence de sels métalliques (notamment de vanadium) en formant du noir d'aniline. Elle réagit avec l'acide chlorhydrique et le chlorate de potassium en formant du chloranile. L'oxydation par le permanganate de potassium produit du nitrobenzène en milieu neutre, de l'azobenzène de l'ammoniaque et de l'acide oxalique en milieu basique, et du noir d'aniline en milieu acide. Elle réagit avec l'acide hypochloreux en formant du para-amino phénol et du para-amino diphénylamine.Tout comme le benzène ou le phénol, l'aniline est réactive par substitution électrophile aromatique. Par exemple, elle peut être subir une sulfonation pour former de l'acide sulfonique, qui peut être transformé en sulfonamides (médicaments très utilisé au début du XXe siècle comme antiseptique.
L'aniline réagit avec l'acide nitreux en formant des sels de diazonium. Par leur intermédiaire, le groupement -NH3 peut être transformé de manière simple en groupement -OH, -CN ou -halogénure.
Usages
Son intérêt commercial originel vient de sa capacité à teindre avec un bon rendement ; La découverte de la mauvéine par William Henry Perkin en 1858 a initié la découverte d'un grand nombre de colorants qui se comptèrent bientôt par centaines. En sus des teintures, l'aniline a été le produit de départ de la synthèse d'un grand nombre de médicaments.
Jusqu'à l'arrivée du stylo à bille, les crayons à l'aniline connurent un grand succès. Malgré la toxicité, on en mouillait la pointe du bout de la langue pour en obtenir un trait bleu intense et indélébile. L'encre à aniline était également utilisée dans le cadre de la reproduction mécanique de documents (procédé dit d'hectographie (en)).
À l'heure actuelle, l'utilisation la plus importante de l'aniline concerne la fabrication du 4,4'-MDI, qui utilise environ 85 % de l'aniline produite. Parmi les autres utilisations, on peut citer la fabrication chimique de caoutchouc (9 %), d'herbicides (2 %) et de pigments ou agents colorants (2 %).
Eau d'aniline
Utilisée comme réactif chimique en biologie, notamment en mycologie pour aider à la détermination des cortinaires (même précautions que pour l'aniline, poison, corrosif, craint la lumière) :
- SeO2 .............1 g.
- Eau distillée....10 cc.
Fabrication
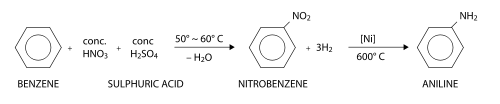
L'aniline peut être fabriquée à partir du benzène en deux étapes. Au cours de la première étape, le benzène subit une nitration (substitution électrophile aromatique utilisant de l'acide nitrique) pour former du nitrobenzène. Au cours de la seconde étape, le nitrobenzène est réduit pour former l'aniline. Un grande variété de réactifs réducteurs peuvent être employés au cours de cette seconde étape, dont notamment du dihydrogène (en présence d'un catalyseur), du sulfure d'hydrogène, ou des métaux comme le fer, le zinc ou l'étain.
Toxicité et sécurité
L'aniline, très toxique, doit être manipulée avec précaution. La classification CEE (étiquetage réglementaire des substances et préparations dangereuses) l'a classée comme «très toxique pour les organismes aquatiques, et dangereuse pour l'environnement».
Une exposition à des concentrations élevées peut être mortelle. Elle peut être absorbée par inhalation, ingestion et contact avec la peau, y compris sous forme vapeur. Chauffée à plus de 190 °C, elle se décompose en produisant des fumées toxiques (contenant notamment de l'ammoniaque).
Certains organismes classent l'aniline dans la liste des substances cancérigènes. Cependant, l'Agence internationale de recherche sur le cancer la classe sur la liste 3 ("classification impossible quant au pouvoir cancérogène pour les humains"), les données disponibles étant contradictoires et trop peu nombreuses.
La Dose létale 50 a été évaluée à 250 mg·kg-1 par voie orale chez le rat[14].
La valeur limite d'exposition professionnelle est fixée en France à 2 ppm, soit 10 mg·m-3.
Controverse
Des études épidémiologiques ont lié des mélanges d'huile contenant de l'huile de colza dénaturée et de l'aniline avec l'épidémie de « syndrome de l'huile toxique » qui a touché l'Espagne en 1981 et fait environ 20 000 malades graves, entraînant 12 000 hospitalisations et plus de 350 décès. L'étiologie de ce syndrome demeure inconnue.
Notes et références
- ANILINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 978-0-471-98369-9) (LCCN 98018212)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 978-0-07-049841-9) (LCCN 96051648), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 978-0-88415-858-5) (LCCN 96036328)
- Aniline sur www.reciprocalnet.org. Consulté le 12 décembre 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Aniline » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- Aniline sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- D'après Fiches de sécurité sur Sciences Physiques et Chimiques, Académie de Nancy-Metz.
Lien interne
Liens externes
(en) « Aniline », dans Encyclopædia Britannica, 1911 [détail de l’édition] [lire en ligne]
Catégories :- Produit chimique toxique
- Produit chimique dangereux pour l'environnement
- Cancérogène chimique
- Aminobenzène
Wikimedia Foundation. 2010.